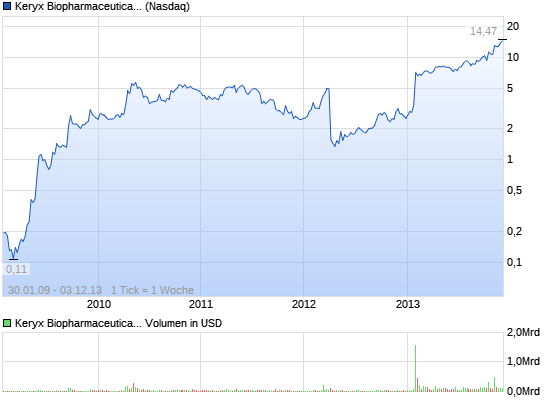
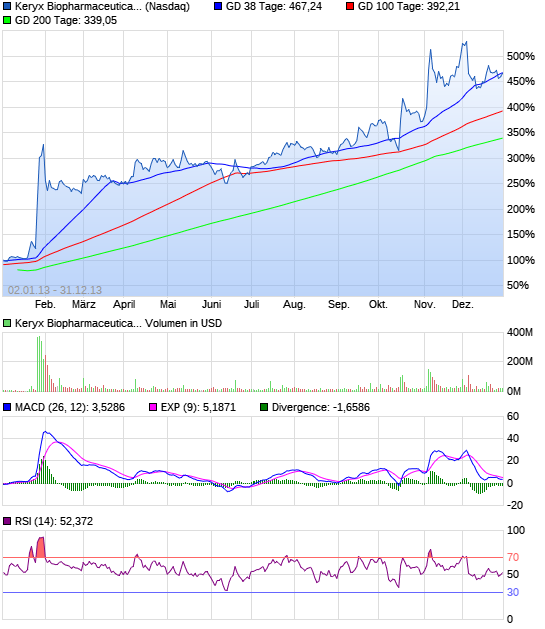
Das könnte abgehen....
Seite 42 von 44 Neuester Beitrag: 24.04.21 23:50 | ||||
| Eröffnet am: | 30.01.09 11:58 | von: Touwse | Anzahl Beiträge: | 2.094 |
| Neuester Beitrag: | 24.04.21 23:50 | von: Franziskasha. | Leser gesamt: | 121.883 |
| Forum: | Hot-Stocks | Leser heute: | 33 | |
| Bewertet mit: | ||||
| Seite: < 1 | ... | 38 | 39 | 40 | 41 | | 43 | 44 > | ||||
http://finance.yahoo.com/news/...still-well-positioned-130635318.html
http://finance.yahoo.com/news/...-announces-issuance-u-133000656.html
Keryx Biopharmaceuticals, Inc. 18. Dezember 2013 08.30 Uhr
NEW YORK, 18. Dezember 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ) gab heute bekannt, dass das US-Patent-und Markenamt hat US-Patent Nr. 8.609.896 erteilt. Das Patent, das im Jahr 2024 abgelaufen ist, beansprucht oral verabreichbaren Formen Zerenex von Eisencitrat hergestellt mit einer BET-aktive Oberfläche von mehr als etwa 16 m² / g auf. Die pharmazeutischen Wirkstoff (API) von Zerenex ist Eisencitrat mit einer BET-Oberfläche im wesentlichen oberhalb dieser Oberfläche Schwellenwert.
Das neu erteilte Patent weiter verbessert Taste Patentfamilie des Unternehmens, die US-Patente Nr. 7.767.851, 8.299.298 und 8.338.642 umfasst. Diese US-Patente laufen im Jahr 2024 ohne Patentlaufzeitverlängerung und enthalten Zusammensetzung und Verwendung der Claims Zerenex.
Ron Bentsur, Chief Executive Officer von Keryx, kommentierte: "Wir glauben, dass unser Portfolio von Patenten wird die Marktexklusivität für Zerenex bieten durch mindestens 2024, wie der Hoch API Oberfläche unserer Eisenzitrat ist für Zerenex" Tätigkeit und Auflösung. Die Patent heute veröffentlichten verbessert unsere IP-Portfolio durch den Schutz der oral anwendbare Formen der Zerenex. " Herr Bentsur fuhr fort: "Wir sind verpflichtet, den Schutz der langfristige Marktpotenzial für Zerenex durch die Stärkung des Patentportfolios und wir glauben, dass die heute erteilte Patent ist ein weiterer wichtiger Erfolg in Richtung dieses Ziels."
Das Unternehmen setzt auf weitere Patentanträge Zerenex, die, wenn sie ausgegeben werden, würde den Rahmen von Patentansprüchen für Zerenex über 2030 hinaus zu erweitern verfolgen.
Die Gesellschaft New Drug Application für Zerenex ist derzeit von der Food and Drug Administration mit einem zugewiesenen Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmaceuticals ist auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisenzitrat Koordinationskomplex), eine mündliche, Eisen-III-basierte Verbindung. Keryx hat einen US-amerikanischen klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphatspiegel) bei Patienten mit chronischer Nierenkrankheit, Dialyse, gemäß einem Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration (abgeschlossen FDA). Die Gesellschaft New Drug Application (NDA) ist derzeit von der FDA mit einer zugeordneten Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) steht noch aus. Das Unternehmen entwickelt auch Zerenex in den USA für das Management der erhöhten Phosphor-und Eisenmangelanämie bei Patienten mit Stadium 3 bis 5 nicht-Dialyse abhängig chronischen Nierenerkrankung. Außerdem Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd hat seine New Drug Application für die Marktzulassung von Eisen-III-Citrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung eingereicht. Keryx hat seinen Hauptsitz in New York City.
Warnhinweis
Einige der in dieser Pressemitteilung, insbesondere im Zusammenhang mit dem geistigen Eigentum von Zerenex (Eisenzitrat Koordinationskomplex) enthalten Aussagen, Ergebnisse klinischer Studien, die klinischen Vorteile, die aus Zerenex abgeleitet werden, Zulassungsanträge und Zulassungen, die kommerziellen Chancen-und Wettbewerbs Positionierung, und alle Geschäftsaussichten für Zerenex, möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Unsicherheiten beinhalten. Bei diesen Aussagen beanspruchen wir den Schutz der Safe-Harbor in dem Private Securities Litigation Reform Act von 1995 enthaltenen zukunftsgerichteten Aussagen. Zu den Faktoren, die dazu führen unsere tatsächlichen Ergebnisse abweichen könnten, sind: die Annahme der NDA-Antrag stellt nur eine vorläufige Bewertung der Anwendung und ist kein Hinweis auf Mängel, die bei der FDA-Überprüfung identifiziert werden kann, ein PDUFA Ziel Datum unterliegt zu verändern und garantiert nicht, dass die Überprüfung der NDA wird zeitnah abgeschlossen werden, das Risiko, dass die FDA, EMA, und / oder das japanische Ministerium für Gesundheit, Arbeit und Wohlfahrt letztlich verweigern Zustimmung der US-NDA, MAA und / oder japanischen NDA sind; die Gefahr, dass Schutzgebiete sind keine Garantie, dass die FDA genehmigt wird letztlich ein Produktkandidat folgenden Einreichung Annahme, ob die FDA und EMA mit unserer Interpretation unserer Phase-3-Studienergebnisse, unterstützende Daten oder stimmen die Durchführung von Studien, ob Zerenex, wenn genehmigt, wird erfolgreich eingeführt und vermarktet werden, sowie andere Risikofaktoren von Zeit zu Zeit in unseren Berichten an die Securities and Exchange Commission identifiziert. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung gelten nur ab dem Datum dieser Pressemitteilung. Wir sind nicht verpflichtet, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser auftreten zu reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar http://www.keryx.com . Die auf unserer Website Informationen nicht durch Bezugnahme in diese Pressemitteilung aufgenommen und wird nur zu Referenzzwecken enthalten.
Kontakt:
KERYX-Kontakt:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
Keryx Fact Sheet http://www.keryx.com/keryx-fact-sheet/
Presentation Scheduled for Wednesday, January 15th at 8:30 a.m. PT
http://finance.yahoo.com/news/...s-present-32nd-annual-133000388.html
http://finance.yahoo.com/news/...es-marketing-approval-130000047.html
NEW YORK, 17. Januar 2014 / PRNewswire / - Keryx Biopharmaceuticals, Inc. ( KERX ) gab heute bekannt, dass seine japanischen Partner, Japan Tobacco Inc. (JT), hat die Herstellung und Zulassung von Eisen Citrat aus dem japanischen Ministerium für empfangene Gesundheit, Arbeit und Wohlfahrt. Eisen-III-Citrat, in Japan von JT-Tochter vermarktet werden, Torii Pharmaceutical Co., Ltd, unter dem Markennamen Riona ® wird als orale Therapie zur Verbesserung der Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung (CKD), einschließlich Dialyse angegeben und Nicht-Dialyse abhängig CKD.
Unter dem Lizenzvertrag mit JT und Torii, innerhalb von 30 Tagen, Keryx wird eine nicht rückzahlbare Anzahlung von 10 Millionen Dollar für die Erreichung des Marktzulassung Meilenstein erhalten. Keryx erhalten ebenfalls zweistellige abgestufte Lizenzgebühren auf den Nettoumsatz von Riona ® in Japan, sowie weitere bis zu 55.000.000 $ an die Erreichung bestimmter Meilensteine Jahresumsatz.
Ron Bentsur, Chief Executive Officer von Keryx, kommentierte: "Diese erste Zulassung von Eisen Citrat ist eine monumentale Leistung für die Zerenex Programm, und wir gratulieren unserem Partner, JT / Torii, auf die Erreichung dieses wichtige und spannende Meilenstein." Herr Bentsur fuhr fort: "Wir glauben, dass Riona ® wird die Phosphatbinder der Wahl in Japan sowohl in der Dialyse und Prä-Dialysepatienten zu werden."
Der US-Zulassungsantrag für Zerenex ist derzeit von der Food and Drug Administration mit einem zugewiesenen Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014.
Keryx Biopharmaceuticals behält eine weltweite exklusive Lizenz (außer für die Asien-Pazifik-Region) zu Zerenex (Eisenzitrat Koordinationskomplex) aus Panion & BF Biotech, Inc. Das Unternehmen hat die Entwicklung der Eisen-III-Citrat in Japan, um JT und Torii lizenziert.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmaceuticals ist auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisenzitrat Koordinationskomplex), eine mündliche, Eisen-III-basierte Verbindung. Keryx hat einen US-amerikanischen klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphatspiegel) bei Patienten mit chronischer Nierenerkrankung (CKD) an der Dialyse abgeschlossen ist, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Ernährungs-und Drug Administration (FDA). Die Gesellschaft New Drug Application (NDA) ist derzeit von der FDA mit einer zugeordneten Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) steht noch aus. Das Unternehmen entwickelt auch Zerenex in den USA für das Management der erhöhten Phosphor-und Eisenmangelanämie bei Patienten mit Stadium 3 bis 5 nicht-Dialyse abhängig CKD. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd die Marktzulassung von Eisen-III-Citrat (Marken Riona ®) in Japan für die Verbesserung der Hyperphosphatämie bei Patienten mit CKD, einschließlich Dialyse und Nicht-Dialyse abhängig empfangen CKD. Keryx hat seinen Hauptsitz in New York City.
Warnhinweis
Einige der in dieser Pressemitteilung, insbesondere in Bezug auf die Ergebnisse der klinischen Studien enthalten Aussagen, die klinischen Vorteile, die aus Zerenex, Zulassungsanträge und Zulassungen, die kommerziellen Chancen und Wettbewerbspositionierung und alle Geschäftsaussichten für Zerenex abgeleitet werden kann in die Zukunft gerichtete Aussagen, die eine Reihe von Risiken und Unsicherheiten beinhalten. Bei diesen Aussagen beanspruchen wir den Schutz der Safe-Harbor in dem Private Securities Litigation Reform Act von 1995 enthaltenen zukunftsgerichteten Aussagen. Zu den Faktoren, die dazu führen unsere tatsächlichen Ergebnisse abweichen könnten, sind: die Annahme der NDA-Antrag stellt nur eine vorläufige Bewertung der Anwendung und ist kein Hinweis auf Mängel, die bei der FDA-Überprüfung identifiziert werden kann, ein PDUFA Ziel Datum unterliegt zu verändern und garantiert nicht, dass die Überprüfung der NDA wird zeitnah abgeschlossen werden, das Risiko, dass die FDA und / oder EMA letztlich verweigern Zustimmung der US-NDA und / oder MAA sind; die Gefahr, dass Schutzgebiete sind keine Garantie, dass die FDA genehmigt wird letztlich ein Produktkandidat folgenden Einreichung Annahme, ob die FDA und EMA mit unserer Interpretation unserer Phase-3-Studienergebnisse, unterstützende Daten oder die Durchführung der Studien einig, ob Riona ® erfolgreich gestartet und von unserem japanischen Partner, JT und Torii vermarktet; ob Zerenex, wenn von der FDA und / oder EMA genehmigt wird, wird erfolgreich eingeführt und vermarktet werden, sowie andere Risikofaktoren, die von Zeit zu Zeit in unseren Berichten an die Securities and Exchange eingereicht identifiziert Kommission. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung gelten nur ab dem Datum dieser Pressemitteilung. Wir sind nicht verpflichtet, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser auftreten zu reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar http://www.keryx.com . Die auf unserer Website Informationen nicht durch Bezugnahme in diese Pressemitteilung aufgenommen und wird nur zu Referenzzwecken enthalten.
KERYX-Kontakt:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
http://www.fool.com/investing/general/2014/01/17/...rmaceuticals.aspx
So, während eine japanische Zulassung ist ein schöner Kopf und sogar ein Potential Vorbote der Dinge, die kommen, sind die realen Preise noch am Horizont. Die gute Nachricht ist, dass die Analysten von Roth Capital, unter anderen, sind optimistisch, was die Chancen des Medikaments in den USA und der EU, erhöhen ihre Kursziele um nicht weniger als einen ins Auge fallenden 100% vom aktuellen Niveau, als Ergebnis. Mit solchen Optimismus umliegenden Keryx, möchten Sie vielleicht, um Vorsprünge auf diesem überzeugende Biotech-Geschichte zu halten für die Zukunft.
Keryx Biopharmaceuticals Announces Appointment of Daniel W. Olmstead as Vice President, Payer Access
14:35 21.01.14
http://www.ariva.de/news/...ad-as-Vice-President-Payer-Access-4906727
http://www.ariva.de/news/...ffering-of-Common-Stock-4907344?secu=3397
22.20 21.01.14
PR Newswire
NEW YORK, 21. Januar 2014
NEW YORK, Januar 21, 2014 / PRNewswire / - Keryx Biopharmaceuticals, Inc. (Nasdaq: KERX) gab heute bekannt, dass es eine $ 90.000.000 garantierten öffentlichen Angebot von Aktien seiner Stammaktien begonnen. In Zusammenhang mit diesem Angebot erwartet Keryx zu den Konsortialbanken eine 30-tägige Option gewähren, zusätzliche Stammaktien in Höhe von bis zu 15% der Anzahl der Stammaktien im Rahmen des Angebots verkauften kaufen. JP Morgan als alleiniger Book-Running-Manager in das Angebot auf. Keryx beabsichtigt, den Nettoerlös aus dem Verkauf seiner Stammaktien zu verwenden, um pre-launch/launch Lageraufbau und pre-commercial/commercial Aktivitäten Zerenex, die Weiterentwicklung der Zerenex in der Vor-Dialyse und andere allgemeine Unternehmensbezogenen Finanzierung Zwecke.
Die oben beschriebenen Wertpapiere werden von Keryx nach einem Formblatt S-3-Shelf Registration Statement (einschließlich eines Basisprospekts), die zuvor bei der Securities and Exchange Commission ("SEC") eingereicht angeboten. Bevor Sie investieren, sollten Sie den Prospekt in der Registrierungserklärung und die damit verbundenen vorläufiger Prospektnachtrag lesen, dass Keryx wurde bei der SEC für mehr alle Informationen über Keryx und dieses Angebot eingereicht. Der vorläufige Prospektnachtrag ist über EDGAR auf der Website der SEC unter sich kostenlos zur Verfügung www.sec.gov . Kopien des vorläufigen Prospektergänzung und begleitende Prospekt kann auch aus den Büros von JP Morgan Securities LLC erhalten werden kann, c / o Broadridge Financial Solutions, 1155 Long Island Avenue, Edgewood, New York 11717 (Telefon: 866-803-9204).
Diese Pressemitteilung stellt weder ein Angebot zum Verkauf oder eine Aufforderung zur Abgabe eines Angebots zum Kauf dieser Wertpapiere, noch wird es keinen Verkauf dieser Wertpapiere in irgendeinem Staat oder anderen Jurisdiktionen, in denen ein solches Angebot, eine solche Aufforderung oder Verkauf ungesetzlich wäre vor der sein Registrierung oder Qualifizierung nach den Wertpapiergesetzen eines solchen Staates oder einer anderen Gerichtsbarkeit. Das Angebot ist abhängig von Marktbedingungen, und es kann nicht garantiert werden, ob und wann die Transaktion abgeschlossen werden kann, oder als auf die tatsächliche Größe oder Bedingungen des Angebots sein.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmaceuticals ist auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisenzitrat Koordinationskomplex), eine mündliche, Eisen-III-basierte Verbindung, die die Fähigkeit zu binden, Phosphat und bilden nicht-resorbierbaren Komplexe hat. Zerenex hat einen US-amerikanischen klinischen Phase-3-Programm für die Behandlung von Hyperphosphatämie (erhöhte Phosphatspiegel) bei Patienten mit terminaler Nierenerkrankung abgeschlossen ist, durchgeführt im Rahmen eines Special Protocol Assessment ("SPA") Vereinbarung mit der FDA. Keryx New Drug Application ("NDA") bei der FDA im Jahr 2013 eingereicht, wird derzeit überprüft und hat einen zugewiesenen Prescription Drug User Fee Act ("PDUFA") Ziel Datum vom 7. Juni 2014. Zerenex hat auch eine Phase-2-Studie in den USA für das Management von erhöhten Serumphosphorspiegel und Eisenmangelanämie bei Patienten mit Stadium 3 bis 5 nicht-Dialyse abhängig chronischen Nierenerkrankung. Top-Line-Ergebnisse aus dieser Phase-2-Studie wurden am 5. November 2013 bekannt gegeben. Außerdem Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd, die ihren NDA in Japan im Jahr 2013 eingereicht wurde, erhielt die Genehmigung von Eisen Citrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung am 17. Januar 2014. Keryx hat seinen Hauptsitz in New York City.
SOURCE Keryx Biopharmaceuticals, Inc.
Quelle: PR Newswire
http://www.ariva.de/news/...ffering-of-Common-Stock-4908846?secu=3397
01.45 23.01.14
PR Newswire
NEW YORK, 22. Januar 2014
NEW YORK, Januar 22, 2014 / PRNewswire / - Keryx Biopharmaceuticals, Inc. (NASDAQ: KERX) gab heute die Preisgestaltung einer garantierten öffentlichen Angebot von Stammaktien, bestehend aus 6.900.000 Aktien bei $ 14,50 pro Aktie. Im Zusammenhang mit diesem Angebot gewährt Keryx der Konsortialbanken eine 30-tägige Option zum Stammaktien purchaseadditional, gleich bis zu 15% der Anzahl der Stammaktien im Rahmen des Angebots verkauft. Keryx beabsichtigt, den Nettoerlös aus dem Verkauf der Stammaktien zu verwenden, um pre-launch/launch Lageraufbau und pre-commercial/commercial Aktivitäten Zerenex, die Weiterentwicklung der Zerenex in der Vor-Dialyse und andere allgemeine Unternehmensbezogenen Finanzierung Zwecke.
JP Morgan Securities LLC als alleiniger Book-Running-Manager handeln im Angebot. Die Co-Manager für das Angebot sind Oppenheimer & Co. Inc., JMP Securities LLC, Stifel, Nicolaus & Company, Incorporated, Roth Capital Partners, LLC, Brean Capital, LLC, Ladenburg Thalmann & Co. Inc. und HC Wainwright & Co., LLC. Maxim Group LLC und Trout Capital LLC als Berater für das Unternehmen tätig.
Die oben beschriebenen Wertpapiere werden von Keryx nach einem Formblatt S-3-Shelf Registration Statement (einschließlich eines Basisprospekts), die zuvor bei der Securities and Exchange Commission ("SEC") eingereicht angeboten. Bevor Sie investieren, sollten Sie den Prospekt in der Registrierungserklärung und die damit verbundenen Prospektergänzung, die Keryx wurde bei der SEC für mehr alle Informationen über Keryx und dieses Angebot eingereicht lesen. Der Prospekt Ergänzung ist über EDGAR auf der Website der SEC unter sich kostenlos zur Verfügung www.sec.gov . Kopien des Prospektergänzung und Begleitprospekt kann auch aus den Büros von JP Morgan Securities LLC erhalten werden kann, c / o Broadridge Financial Solutions, 1155 Long Island Avenue, Edgewood, New York 11717 (Telefon: 866-803-9204).
Diese Pressemitteilung stellt weder ein Angebot zum Verkauf oder eine Aufforderung zur Abgabe eines Angebots zum Kauf dieser Wertpapiere, noch wird es keinen Verkauf dieser Wertpapiere in irgendeinem Staat oder anderen Jurisdiktionen, in denen ein solches Angebot, eine solche Aufforderung oder Verkauf ungesetzlich wäre vor der sein Registrierung oder Qualifizierung nach den Wertpapiergesetzen eines solchen Staates oder einer anderen Gerichtsbarkeit.
http://finance.yahoo.com/news/...s-present-16th-annual-133000140.html
Presentation Scheduled for Monday, February 10th at 4:00pm ET
Globenewswire
Keryx Biopharmaceuticals, Inc. Vor 5 Stunden
NEW YORK, 6. Februar 2014 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ) gab heute bekannt, dass Ron Bentsur, Chief Executive Officer des Unternehmens, wird auf der 16. Annual BIO CEO & Investor Conference präsentiert werden, zu sein statt von 10. bis 11. Februar 2014 im Waldorf Astoria Hotel in New York City. Herr Bentsur Vortrag findet am Montag, den 10. Februar um 4:00 Uhr ET.
Ein Live-Audio-Webcast der Herr Bentsur Präsentation wird im Investor-Relations-Website des Unternehmens unter zugänglich sein http://www.keryx.com/webcasts-presentations . Eine archivierte Version des Webcast wird nach Abschluss der Live-Präsentation zur Verfügung stehen.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmaceuticals ist auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex TM (Eisenzitrat Koordinationskomplex), eine mündliche, Eisen-III-basierte Verbindung. Zerenex hat einen US-amerikanischen klinischen Phase-3-Programm für die Behandlung von Hyperphosphatämie (erhöhte Phosphatspiegel) bei Patienten mit chronischer Nierenkrankheit, Dialyse abgeschlossen ist, durchgeführt im Rahmen eines Special Protocol Assessment ("SPA") Vereinbarung mit der FDA. Keryx New Drug Application ("NDA") bei der FDA im Jahr 2013 eingereicht, wird derzeit überprüft und hat einen zugewiesenen Prescription Drug User Fee Act ("PDUFA") Ziel Datum vom 7. Juni 2014. Zerenex hat auch eine Phase-2-Studie in den USA für das Management von erhöhten Serumphosphorspiegel und Eisenmangelanämie bei Patienten mit Stadium 3 bis 5 nicht-Dialyse abhängig chronischen Nierenerkrankung. Top-Line-Ergebnisse aus dieser Phase-2-Studie wurden im November 2013 angekündigt. Außerdem Keryx japanischen Partner, Japan Tobacco, Inc. und Torii Pharmaceutical Co., Ltd, die Marktzulassung von Eisen-III-Citrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung am 17. Januar 2014. Keryx hat seinen Hauptsitz in New York City.
Kontakt:
KERYX-Kontakt:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
RTTNews.com) - Keryx Biopharmaceuticals Inc. ( KERX ) bekannt, dass es Greg Madison als Executive Vice President und Chief Operating Officer ernannt. In dieser Rolle wird Madison den Aufbau von Handelsorganisation und die damit verbundenen Funktionen führen, um eine mögliche Zerenex Produkteinführung in den Vereinigten Staaten und international zu unterstützen.
Click Here!
Madison tritt in die Gesellschaft von AMAG Pharmaceuticals ( AMAG ), wo er als Executive Vice President und Chief Commercial Officer serviert. Vor der AMAG, verbrachte 12 Jahre bei Madison Genzyme / Sanofi entwickelt umfangreiche Handels-und General Management Know-how, als er in Funktionen mit zunehmender Verantwortung und Führung, die ihren Höhepunkt in seiner jüngsten Rolle als Vice President und General Manager des Geschäftsbereichs Renal fortgeschritten ist.
Vorkenntnisse Madison in der Renal Division enthalten, der als Vice President und General Manager des US-Geschäfts, Vizepräsident der US-Verkäufe, und Vizepräsident der US-Marketing, wo er alle Pre-Launch-Vorbereitung für Renvela, jetzt die führende Phosphatbinder in der US-Markt.
Während seiner Amtszeit mit Genzyme, Madison hatte auch Rollen im Vertriebsmanagement, Schulung, verwaltet Märkte und die Erstattung. Vor seinem Eintritt bei Genzyme, verbrachte Madison fünf Jahre Jannsen Pharmaceuticals im Vertrieb und Vertriebsmanagement Rollen und begann seine Karriere in der pharmazeutischen Industrie im Vertrieb mit Wyeth-Ayerst.
Für Kommentare und Feedback: Kontakt editorial@rttnews.com
http://www.rttnews.com
Dieser Artikel erscheint in Schlagzeilen
Referenzierte Aktien: AMAG , KERX , SNY
Read more: http://www.nasdaq.com/article/...and-coo-20140210-00579#ixzz2swIkyDib
Wechsel im Verwaltungsrat oder Haupt Officers, Jahresabschluss und
http://biz.yahoo.com/e/140210/kerx8-k.html
Artikel 5.02 Abfahrt der Verwaltungsrat oder Bestimmte Officers, Wahl des Vorstands; Ernennung Bestimmte Officers; Ausgleichsvereinbarungen der Bestimmte Officers
Effektive 8. Februar 2014, Keryx Biopharmaceuticals, Inc. (das "Unternehmen") hat Herrn Gregory P. Madison als Executive Vice President und Chief Operating Officer des Unternehmens und eine Vereinbarung, vom 21. Januar 2014 (die "Beschäftigung eingegeben Vertrag ") über die Bedingungen der Herr Madison Beschäftigung bis zum 15. Februar 2017, es sei denn auf der gegenseitigen, schriftlichen Vereinbarung der Parteien verlängert.
Vom 2. Januar 2013 an 7. Februar 2014 war Herr Madison mit AMAG Pharmaceuticals (NASDAQ: AMAG), wo er als Executive Vice President und Chief Commercial Officer serviert. Vor der AMAG war Herr Madison 12 Jahre bei Genzyme / Sanofi mit seiner letzten Rolle als Vice President und General Manager des Geschäftsbereichs Renal dient. Vorkenntnisse Mr. Madison in der Nierenteilung Genyme / Sanofi enthalten auch als Vice President und General Manager des US-Geschäfts dient, Vizepräsident der US-Umsatz, und der Vizepräsident der US-Marketing. Während seiner Amtszeit mit Genzyme, Mr. Madison hatte auch Rollen im Vertriebsmanagement, Schulung, verwaltet Märkte und die Erstattung. Vor seinem Eintritt bei Genzyme, verbrachte Herr Madison fünf Jahre Jannsen Pharmaceuticals im Vertrieb und Vertriebsmanagement Rollen und begann seine Karriere in der pharmazeutischen Industrie im Vertrieb mit Wyeth-Ayerst. Er hält einen Bachelor of Business Administration in Finance von der University of Massachusetts, Amherst.
Unter dem Arbeitsvertrag wird Herr Madison Grundgehalt gleich $ 400.000 pro Jahr, vorbehaltlich erhöht sich um den Vergütungsausschuss des Board of Directors der Gesellschaft (der "Ausschuss") jederzeit nach eigenem Ermessen zu sein. Herr Madison Grundgehalt darf nur in Verbindung mit einer entsprechenden Herabsetzung der Vergütung für alle anderen Vorstandsmitglieder reduziert werden. Herr Madison ist auch berechtigt, einen jährlichen diskretionären Bonus erhalten, 50% seines Grundgehalts nicht überschreiten, wenn bestimmte Leistungsziele im Ermessen des Ausschusses erfüllt sind.
Am 8. Februar 2014 wurde Herr Madison 85.000 Aktien der Gesellschaft beschränkt Stammaktien (die "Lizenz Grant") gewährt, Optionen, um zusätzliche 80.000 Aktien der Stammaktien des Unternehmens (die "Option Grant") und weitere Optionen zum Kauf erwerben zusätzlich 115.000 Aktien der Stammaktien des Unternehmens (die "Milestone Option Grant") unterliegt den Bestimmungen und Bedingungen des Unternehmens Aktienplänen. The Stock Grant um 25.000 Aktien sofort unverfallbar, die restlichen 60.000 Aktien werden über drei Jahre mit dem ersten Drittel Sperrfrist am 8. Februar 2015 und danach die restlichen Anteile werden in gleichen vierteljährlichen Raten ab 8. Februar 2015 durch Weste Weste 8. Februar 2017, Anlage auf Weiterbeschäftigung Mr. Madison. Die Option Grant über drei Jahre mit dem ersten Drittel Unverfallbarkeit auf 8. Februar 2015 bekleiden, und danach werden die restlichen Anteile werden zu gleichen vierteljährlichen Raten von 8. Februar 2015 bis 8. Februar 2017 bekleiden, auf Weiterbeschäftigung Mr. Madison Anlage . Das Milestone Option Zuteilung wird, wie folgt:
(I) 15.000 Optionen Ausübungs auf den ersten kommerziellen Verkauf von Zerenex ™ (Eisenzitrat Koordinationskomplex) innerhalb von 90 Tagen nach der Marktzulassung durch die FDA,
(Ii) 30.000 Optionen Ausübungs auf konsolidierte Umsatz für Zerenex ³ $ 25.000.000 in einem Kalendervierteljahr, (iii) 30.000 Optionen Ausübungs auf konsolidierte Umsatz für Zerenex ³ $ 50.000.000 in einem Kalendervierteljahr, und (iv) 40.000 Optionen Ausübungs auf konsolidierte Umsatz für Zerenex ³ $ 75.000.000 in einem Kalendervierteljahr, auf Weiterbeschäftigung Mr. Madison konditioniert.
Unter dem Arbeitsvertrag wird Herr Madison, Bargeld Abfindungszahlungen berechtigt, wenn das Unternehmen seine Tätigkeit beendet, ohne Grund (wie in der Arbeitsvertrag definiert) oder wenn Herr Madison tritt seine Beschäftigung aus gutem Grund (wie in der Arbeitsvertrag definiert) .
Im Zusammenhang mit der Ausführung des Arbeitsvertrags vereinbarten Herr Madison nach Unternehmen vertrauliche Informationen und Geschäftsgeheimnisse zu erhalten (wie in der Arbeitsvertrag definiert) und auch auf bestimmte Bündnisse der Wettbewerbs haften.
Die vorstehende Zusammenfassung des Arbeitsvertrages ist in ihrer Gesamtheit durch die Kopie einer solchen Vereinbarung als Anlage 10.1 der vorliegenden Verordnung eingereicht und durch Verweis aufgenommen qualifiziert.
Keine familiären Beziehungen bestehen zwischen Herrn Madison und einem unserer Geschäftsführer oder andere leitende Angestellte. Es gibt keine Absprachen zwischen Herrn Madison und einer anderen Person nach dem Herr Madison wurde als Offizier ausgewählt, noch gibt es irgendwelche Transaktionen, denen die Gesellschaft ist oder war und einen Teilnehmer in dem Herr Madison hat eine wesentliche Beteiligung unterliegt Offenlegung gemäß Artikel 404 (a) der Verordnung SK.
Artikel 9.01 Abschluss und Ausstellungen
(D) Exponate.
Die folgende Ausstellung wird im Rahmen dieses Berichts eingereicht:
Nummer Beschreibung
10.1 Beschäftigungsabkommen mit Gregory P. Madison vom 21. Januar 2014.
Presentation Date: Monday, March 10th, 2014
Presentation Time: 12:00 Noon PT (3:00pmET)
http://www.keryx.com/press-releases/pdfs/2014/1903761.pdf