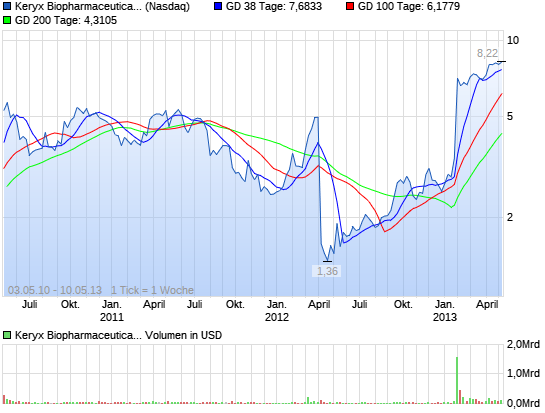
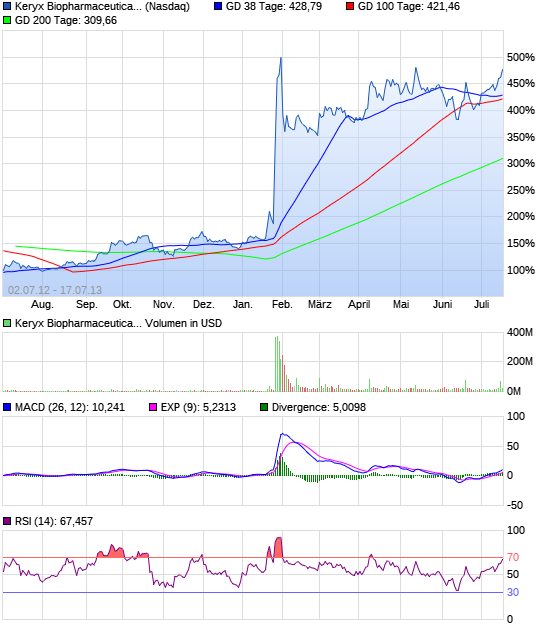
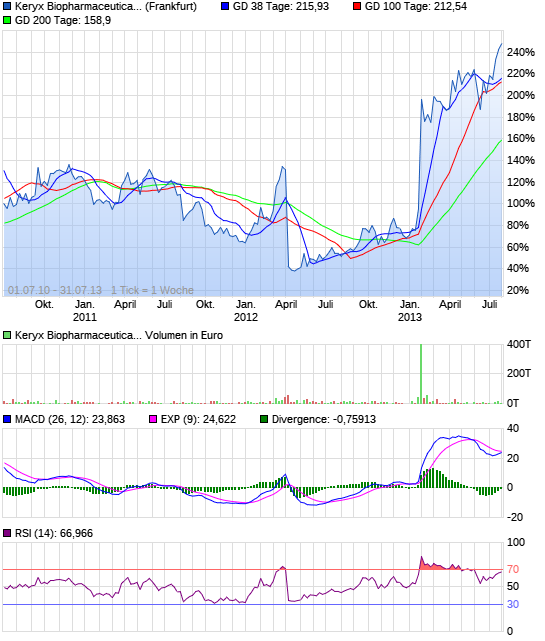
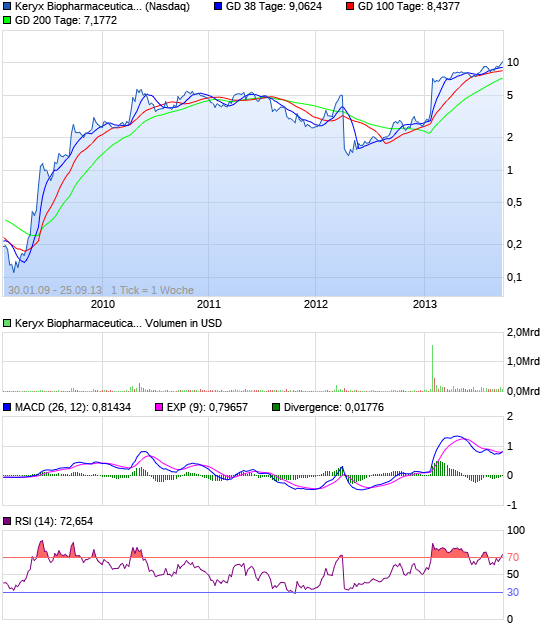
Das könnte abgehen....
Seite 40 von 44 Neuester Beitrag: 24.04.21 23:50 | ||||
| Eröffnet am: | 30.01.09 11:58 | von: Touwse | Anzahl Beiträge: | 2.094 |
| Neuester Beitrag: | 24.04.21 23:50 | von: Franziskasha. | Leser gesamt: | 124.144 |
| Forum: | Hot-Stocks | Leser heute: | 10 | |
| Bewertet mit: | ||||
| Seite: < 1 | ... | 37 | 38 | 39 | | 41 | 42 | 43 | ... 44 > | ||||
http://seekingalpha.com/article/...he-pharmacology-world?source=yahoo
Die Geschichte mit Keryx BioPharmaceuticals ( KERX ) weiter zu entwickeln. Ich mag das Potenzial dieses Unternehmens, seine Verwaltung und sein Potenzial für höhere Preise. Der Trend bleibt sehr stark und ich erwarte, neue 52 Wochen Hochs bald. Ich mag kleine Unternehmen, die das Potenzial, die nächste Celgene (haben CELG ) oder Biogen Idec Inc. ( BIIB ).
Die Geschichte hinter KERX
Im Januar KERX veröffentlicht Top-Line-Phase III über seine Droge Zerenex, eine patentierte Formulierung Eisencitrat sie eine Genehmigung erteilt, für die Behandlung von Hyperphosphatämie bei terminaler Niereninsuffizienz Dialyse-Patienten. Der Aktienkurs verdreifacht in Preis und berührte 10 $. Eine Zweitplatzierung von Aktien wurde bald nach gelegt, die hilft, das Unternehmen auf lange Sicht zu mehr Studien zu analysieren.
Die Zukunft
Im Einklang mit der Gesellschaft SPA Vereinbarung bestand der klinischen Phase-3-Programm für Zerenex von zwei klinischen Pfaden, eine kurzfristige Studie, die erfolgreich abgeschlossen wurde vor etwa zwei Jahren in der langfristigen Sicherheit und Wirksamkeit Studie, die wir heute bekannt gegeben.
Diese langfristige Phase 3 ist daher die zweite und letzte Verpflichtung aus unserer klinischen Phase-3-Programm Teil des SPA. Der nächste Schritt ist zu Beginn der Arbeit in Richtung der New Drug Application (NDA) und europäischen MAA Einreichungen, die beide im zweiten Quartal dieses Jahres erwartet.
Der CEO erklärte:
"Zerenex deutlich gezeigt, sehr robust steigt in Ferritin und TSAT Partituren im Umfang von 51% für Ferritin und 26% für TSAT, während der aktiven Kontrollgruppe unverändert blieb. Die Änderungen in Ferritin und TSAT aufgetreten ziemlich schnell und erreichte nach etwa vier bis fünf Monaten, was auch sehr überzeugend ist, dass die Ferritin und TSAT Ebenen dann bei diesen höheren Ebenen Plateau. Wir glauben, dass dies vielleicht der Körper die natürliche Eisenaufnahme Mechanismen genutzt wird. Und natürlich ist die markante Reduktion der IV-Eisen und ESA Einsatz beobachtet in der Studie, die wirklich ein potenzieller Spiel-Wechsler. "
Fundamentalanalyse
KERX ist sehr stark fundamental . Das Unternehmen hat keine Schulden, die die Chancen einer Zweitplatzierung von Aktien reduziert. Das Unternehmen hat 14.680.000 $ in der Bank.
Das Unternehmen hat 69.000.000 Aktien im Streubesitz. Eine hohe 20% ist kurz, und positive Nachrichten können eine Short-Squeeze zu höheren Preisen zu produzieren. Insider besitzen 15% des Schwimmers, was gut ist. Es war sehr minimal Insider Verkäufe, die ein sehr bullish Szenario ist. Weitere Informationen zu sehen hier .
Technische Analyse
Die Wochen-Chart ist eine Sache der Schönheit. Mit der großen Neuigkeiten im Januar sammelten die Aktie auf neue Höchststände und wurde nun konsolidieren. Ich erwarte, dass ein weiterer großer Anlauf in den Sommer mit neuen Hochs kurz nach.
(Zum Vergrößern klicken)
Fazit
Trotz der jüngsten Aufwertung im Preis, ich weiterhin zu glauben KERX wird höher von hier nach einer Phase der Konsolidierung. Volumen nimmt zu, und ich erwarte, die FDA-Zulassung. KERX können auch als potenzielle Kandidaten Buyout gesehen werden. Das Unternehmen setzt weiterhin auf andere Studien arbeiten, damit das Potenzial für ein höheres Wachstum ist da.
http://www.ariva.de/news/...st-Quarter-2013-Financial-Results-4521006
http://finance.yahoo.com/news/...s-inc-announces-first-203000587.html
Keryx auf Investoren-Telefonkonferenz am Mittwoch, den 8. Mai 2013 um 8:30 Uhr bewirten EDT
NEW YORK, 7. Mai 2013 / PRNewswire / - Keryx Biopharmaceuticals, Inc. ( KERX ), ein biopharmazeutisches Unternehmen, das sich auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen (das "Unternehmen") konzentriert, gab heute seine Ergebnisse für das erste Quartal zum 31. März 2013 beginnen.
Am 31. März 2013 hatte die Gesellschaft Zahlungsmittel und Zahlungsmitteläquivalente von $ 87.300.000, verglichen mit $ 14.700.000 am 31. Dezember 2012 im Vergleich. Am 30. Januar 2013 schloss das Unternehmen einen garantierten öffentlichen Angebot von Stammaktien, die Erlöse der Gesellschaft von ca. 74.800.000 $ zur Verfügung gestellt, nach Abzug von Rabatten und Underwriting bietet Aufwendungen in Höhe von ca. $ 5,6 Millionen Euro. Ebenfalls im Januar 2013 hat die Gesellschaft einen $ 7,0 Mio. Meilensteinzahlung von seinem japanischen Partner für Zerenex (Eisencitrat), Japan Tobacco Inc. ("JT") und Torii Pharmaceutical Co., Ltd ("Torii"), bezogen auf die JT Januar 2013 Einreichung einer New Drug Application ("NDA") mit dem japanischen Ministerium für Gesundheit, Arbeit und Soziales für die Marktzulassung von Eisencitrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung ("CKD").
Der Nettoverlust für das erste Quartal zum 31. März, war 2013 $ 2.100.000, oder $ 0,03 pro Aktie, verglichen mit einem Nettoverlust von $ 9,1 Mio. oder $ 0,13 pro Aktie für das Vergleichsquartal im Jahr 2012, was einem Rückgang der Netto-Verlust von $ 7,0 Millionen. Im Januar 2013 wird die Firma einen Umsatz von $ Lizenz 7,0 Mio. für die Meilenstein-Zahlung von seinem japanischen Partner für Zerenex, JT & Torii empfangen, wie oben beschrieben aufgezeichnet. Der Nettoverlust für das erste Quartal zum 31. März 2013 enthalten $ 0,6 Mio. nicht zahlungswirksame Aufwendungen im Zusammenhang mit Equity Incentive Stipendien.
Stellungnahme zum Quartal, sagte Ron Bentsur, den Chief Executive Officer, "Nach der Bekanntgabe der Top-Line-Daten, konzentrieren wir uns nun unsere Anstrengungen und Ressourcen auf den anhängigen NDA-und MAA-Einreichungen. Wir auch voran mit der US-Phase 2 CKD-Studie, für die wir erwarten, dass Top-Line-Daten im dritten Quartal 2013 zu berichten. "
Die Gesellschaft wird Gastgeber einer Investoren-Telefonkonferenz am morgigen Mittwoch, den 8. Mai 2013 um 8:30 am EDT, der Gesellschaft für das erste Quartal Ergebnisse zu diskutieren und eine Geschäftsaussichten für den Rest des Jahres 2013.
Um an der Telefonkonferenz teilzunehmen, rufen Sie bitte 1-877-869-3847 (USA), 1-201-689-8261 (außerhalb der USA), Call-In-ID: KERYX. Die Audio-Aufzeichnung der Telefonkonferenz zur Verfügung stehen für die Wiedergabe auf http://www.keryx.com , für einen Zeitraum von 15 Tagen nach der Telefonkonferenz.
ÜBER KERYX BIOPHARMACEUTICALS, INC
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat), ein oral, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat und Form nicht resorbierbare Komplexe zu binden. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit end-stage renal disease, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der FDA, abgeschlossen und die New Drug Application Einreichung bei der FDA und der Marketing Authorization Application Einreichung bei der EMA werden bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für das Management von Phosphor und Eisenmangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Warnhinweis
Einige der Aussagen in dieser Pressemitteilung enthalten möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Ungewissheiten in sich bergen sein. Bei diesen Aussagen, dass wir den Schutz des sicheren Hafens für die Zukunft gerichteten Aussagen in dem Private Securities Litigation Reform Act von 1995 enthalten. Die Faktoren, aufgrund derer unsere tatsächlichen Ergebnisse wesentlich abweichen, werden von Zeit zu Zeit in unseren Berichten an die Securities and Exchange Commission eingereicht wurden identifiziert. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung sprechen nur ab dem Datum dieser Pressemitteilung. Wir beabsichtigen nicht, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser Pressemitteilung eintreten reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar unter http://www.keryx.com . Die Informationen auf unserer Website ist nicht durch Bezugnahme in diese Pressemitteilung aufgenommen worden und wird als inaktiv textuelle Referenz nur enthalten.
KERYX CONTACT:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
Keryx Biopharmaceuticals, Inc.
Die jüngsten Short-Interest-Daten wurde von der NASDAQ für den 04/30/2013 Abrechnungstag, die einen Anstieg 1.542.438 Aktien insgesamt kurzen Zinsen für Keryx Biopharmaceuticals Inc. zeigt (veröffentlicht KERX ), Auf 16.859.536, eine Zunahme von 10,07% seit 04/15/2013. Total kurzfristige Interesse ist nur ein Weg, um kurzfristig Daten zu suchen, eine andere Metrik, die wir hier bei Dividende Kanal finden besonders nützlich ist die "Tage zu decken" Metrik, weil es sowohl die gesamten Aktien kurz und die durchschnittliche tägliche Volumen der gehandelten Aktien hält. Die Anzahl der Aktien wird dann kurz zu dem durchschnittlichen täglichen Handelsvolumen im Vergleich, um die Gesamtzahl der Handelstage (am durchschnittlichen Volumen) nehmen es zur Glattstellung aller offenen Short-Positionen, wenn jede Aktie gehandelt vertreten eine Short-Position würde berechnen geschlossen. Durchschnittlicher Tagesumsatz für KERX am 04/30/2013 Siedlung sank auf 2.267.937, verglichen mit 2.964.294 am 04/15/2013 Bericht verglichen. Das brachte "Tage zu decken" bis zu 7,43, eine Steigerung von 43.87% der 5,17 Tage zu decken in der vorangegangenen kurzen Zinsen Datenfreigabe berechnet. Die unten Diagramm zeigt die historischen "Tage zur Deckung" für KERX bei früheren kurzen Zinsen Starttermine:
Laden + + +2013 + Chart TickerTech.com
http://secure.tickertech.com/pics/thestreet/11368209945.gif
Ein erhöhter "Tage zu decken" Wert könnte bedeuten, dass Leerverkäufer sind mit dem Lager, um eine lange Wette anderswo abzusichern, oder könnte auch bedeuten, dass Leerverkäufer halten die Aktie wird im Preis sinken. Wenn Leerverkäufer ihre Positionen decken schließlich per Definition muss es sein Kauf Tätigkeit, weil ein Anteil, der derzeit verkauft wird, muss kurz gekauft abgedeckt werden. So Investoren neigen dazu, ein Auge auf die halten "Tage zu vertuschen" metrisch, weil ein hoher Wert ein schärferes Preiserhöhung vorhersagen konnte das Unternehmen setzen sollte etwas unerwartet gute Nachrichten - Leerverkäufer könnten dann eilen, um ihre Positionen zu decken, und wenn die " Tage zu decken "Zahl hoch ist, wäre es dann schwieriger, diese Positionen ohne Senden der Aktie höher (bis der höhere Preis produziert genug Verkäufer um den erforderlichen Umfang die Leerverkäufer müssen ihre Positionen schließen zu erzeugen) zu schließen.
http://www.fool.com/investing/general/2013/05/19/...oo-much-cash.aspx
Von Max Macaluso, Ph.D.
Die Biotech-Industrie ist voll von kleinen Unternehmen, die Millionen ausgeben Entwicklung neuer Medikamente, die können oder auch nicht bekommen grünes Licht von der Food and Drug Administration. Viele teure Gesicht Rückschläge, wie klinische Studie Ausfälle oder regulatorische Verzögerungen, die sich schnell erschöpfen können ihre Cash-Reserven. Selbst diejenigen, die letztendlich erfolgreich sind in der Regel nicht genug Geld, um ein neues Medikament nehmen den ganzen Weg vom Labor auf den Markt.
Also, wie können Anleger vermeiden, verbrannt von Unternehmen in dieser geldgierige Industrie?
Folgen Sie dem Geld
Bei der Analyse eines Biotech-Lager, ist eines der ersten Dinge, die Investoren benötigen, um zu berechnen, wie viel Geld das Unternehmen verbringt. Diese Zahl, die so genannte "Burn Rate", ist die gesamte Menge an Bargeld, die auf den Betrieb und Investitionen verbracht hat. Lassen Sie uns an einem Beispiel laufen und schauen, wie viel Drogeentwickler Keryx Biopharmaceuticals (NASDAQ: KERX ) Wurde zu verbringen.
Zeitraum
§
Q1 2013
§
Q4 2012
§
Q3 2012
§
Q2 2012
Cash Flow aus laufender
§
($ 2.138)
§
($ 5.566)
§
($ 6.848)
§
($ 3.800)
Kapitalaufwendungen
§
($ 45)
§
($ 5)
§
($ 16)
§
($ 1)
Burn-Rate
§
($ 2.183)
§
($ 5.571)
§
($ 6.864)
§
($ 3.801)
Ave. Burn Rate (LFQ)
§
($ 4.605)
§
Quelle: CapitalIQ; LFQ = letzten vier Quartale, alle Zahlen in Tausend.
Im Durchschnitt hat Keryx gebrannt $ 4.600.000 ein Viertel --- aber nicht alarmiert werden. Die massiven Kosten, die mit Entwicklung von Medikamenten assoziiert zu machen Biotech-berüchtigt für ihre hohen Preise brennen, und diese Zahl sagt nur die Hälfte der Geschichte.
Wie viel Geld steht zur Verfügung?
Investoren haben auch zu beurteilen, ob das Unternehmen genug Geld, um diese Kosten zu unterstützen hat. Let 's Blick auf Keryx Bilanz und sehen, wie viel Geld sie auf der Hand hat:
Zahlungsmittel und Zahlungsmitteläquivalente
§
$ 87,343
Kurzfristige Investitionen
-
§
Insgesamt Kassenbestand
§
$ 87,343
Quelle: CapitalIQ; Daten aus dem letzten Quartal, alle Zahlen in Tausend.
Es sieht aus wie Keryx hatte 87.300.000 $ zur Verfügung am Ende des letzten Quartals. Unter der Annahme, dass die durchschnittliche Brenngeschwindigkeit konstant bleibt, kann Keryx bequem decken ihre Kosten für ein weiteres Jahr und eine Hälfte.
Dilution?
Keryx die starke Cash-Position ist in einem großen Teil durch Kapital, dass sie durch einen letzten Follow-on-Börsengang angehoben. Es gab mehr als 9,4 Millionen neue Aktien und saldiert $ 74.800.000 aus dem Angebot zu helfen, Kraftstoff seine Forschungs-und Entwicklungsanstrengungen. Und das war nicht das erste Mal der Gesellschaft ausgegebenen Aktien mehr, seit Beginn des Jahres 2010, Keryx der insgesamt ausstehenden Aktienanzahl hat sich von fast 56.900.000 bis 81.700.000 erhöht. Dies bedeutet, dass Anleger, die in dieses Lager sprang vor drei Jahren haben ihre gesamten Anteile an der Gesellschaft fallen um etwa 30% gesehen.
Heute jedoch haben die eigentliche Frage Anleger fragen sich, ob Keryx kann seine nächste Katalysator ohne läuft von Bargeld und Aktien Ausstellung mehr zu erreichen.
Woher kommt Keryx stehen?
Keryx war ein heiß diskutiertes Lager unter den Anlegern, die Firma stand vor einer massiven Rückschlag Mitte 2012 nach der Meldung, dass perifosine, ein Darmkrebs Medikament, dass es früher mit Biotech Aeterna Zentaris geteilt, um den primären Endpunkt in einer zulassungsrelevanten klinischen Phase 3 nicht erfüllte Studie. Keryx-Aktie hat eine massive 65% Wäschetrockner in den Nachrichten, aber das Unternehmen nach vorne bewegt mit der Entwicklung seines zweiten Droge, Zerenex.
Zerenex, eine experimentelle Verbindung, die Phosphat-Spiegel bei Dialysepatienten leiden end-stage renal disease senkt, erfolgreich erfüllt ihre primären und sekundären Endpunkte in einer klinischen Phase 3 Studie im Januar. Genauso schnell wie die Aktien im Vorjahr zusammenbrach, sah Investoren Keryx den Wert Rebound , und das Lager ist fast 190% seit Jahresbeginn.
Zerenex ist bereits von den Behörden in Japan, wo Keryx mit Japan Tobacco und Torii Pharmaceutical eine Partnerschaft ist. In den Vereinigten Staaten, hofft Keryx Management, um die NDA zur Genehmigung vorlegen im dritten Quartal dieses Jahres. Unter der Annahme, der Standard 10-Monats-Berichtszeitraum, bedeutet dies, dass Zerenex könnte in der Mitte des Jahres 2014 gestartet werden, wenn es die FDA-Gütesiegel bekommt. Während diese Entscheidung ein Katalysator für die Aktionäre sein wird, und das Unternehmen konnte eine Reihe von Herausforderungen in der Kommerzialisierung des Medikaments konfrontiert , wenn es genehmigt wird, scheint es, als wenn Keryx hat viel Geld, um ihre Operationen fortsetzen und weitere Verdünnung (vor die Entscheidung der FDA, zumindest) sieht höchst unwahrscheinlich.
http://finance.yahoo.com/news/...inc-announces-zerenex-123000297.html
http://finance.yahoo.com/q/ao?s=KERX+Analyst+Opinion
http://investors.keryx.com/...wsArticle&ID=1826253&highlight=
http://beta.fool.com/smartequity/2013/07/24/...ource=eogyholnk0000001
Keryx Biopharmazeutika ist ein Biotechnologie-Unternehmen mit der Akquisition, Entwicklung und Kommerzialisierung von Behandlungen für die renale Erkrankungen beteiligt. Seine primäre Kandidat ist Zerenex, die Phase-III-Studien abgeschlossen hat. Zerenex ist ein orales Präparat mit der Fähigkeit, Phosphat im Magen-Darm-Trakt, die bei der Behandlung von Nierenerkrankungen hilft binden. Das Medikament ist auch in Phase-II-Studien für die Behandlung von anämischen Patienten mit einem Serum-Phosphor-und Eisenmangel.
Im Januar veröffentlichte Keryx Daten aus Phase-III-Studien von Zerenex. Der Markt reagierte positiv auf die veröffentlichten Informationen und Bewertungen von Keryx stieg von ca. US $ 3,5 bis über 9 $. Die veröffentlichten Daten zeigten, dass Zerenex hatte alle primären Endpunkte der Studie erfüllt. Die Versuche maßen die Serumphosphatspiegel in Thema unter Zerenex und die Ergebnisse zeigt, dass sie auch Ebenen mit 4,90 mg / dL am Ende der 4-Wochen-Zeitraum Wirksamkeit und 5,1 mg / dl zu Studienbeginn erhalten. Im Gegensatz zu anderen Konkurrenten bereits auf dem Markt verglichen werden, erfordert weniger Zerenex intravenöse Eisensubstitution und ESA (Erythropoetin Stimulatoren).
Die Wertansätze der Keryx wurden bereits von einem Mammut 344% in den letzten 52-Wochen geschätzt. In den letzten sechs Monaten haben die Organe Keryx Bestände eines Mammuts 35% zugenommen, wodurch 30.000.000 Aktien, um ihre Portfolios. Trotz der jüngsten Anerkennungen, ist das Unternehmen immer noch den Handel in einem 36% Rabatt auf den Mittelwert Sell-Side-Kursziel von $ 13.2. 10 Sell-Side-Analysten eine Kaufempfehlung für Keryx.
Das Patent Klippe hat die Attraktivität von Unternehmen wie Keryx erhöht. Big Pharma erwerben vielversprechende Biotechnologie-Unternehmen, um ihre auslaufenden Patente ergänzen. Keryx seine NDA von August einreichen und es gibt eine hohe Wahrscheinlichkeit, dass Zerenex wird die FDA-Zulassung erhalten. Trotz der Januar Wertansätze Wanderung, es gibt noch mehr Saft in Keryx. Das Unternehmen ist ein attraktives Ziel für die Übernahme Gesundheitswesen Hüne aus dem Patent Klippe.
http://finance.yahoo.com/news/...s-inc-host-conference-203000864.html
Investor Conference Call gehalten Donnerstag, den 1. August 2013 um 8:30 Uhr EDT
NEW YORK, 30. Juli 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ), ein biopharmazeutisches Unternehmen, das sich auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert, gab heute bekannt, dass eine Konferenz Telefonkonferenz wird am Donnerstag, den 1. August 2013 um 8:30 Uhr statt EDT zu den Ergebnissen für das zweite Quartal zum 30. Juni 2013 sowie einer Geschäftsaussichten für den Rest des Jahres 2013 zu diskutieren. Ron Bentsur, Chief Executive Officer von Keryx, werden die Telefonkonferenz.
Um an der Telefonkonferenz teilzunehmen, rufen Sie bitte 1-877-869-3847 (USA), 1-201-689-8261 (außerhalb der USA), Call-In-ID: KERYX. Die Audio-Aufzeichnung der Telefonkonferenz zur Verfügung stehen für die Wiedergabe auf http://www.keryx.com , für einen Zeitraum von 15 Tagen nach der Telefonkonferenz.
Keryx wird seine Finanzergebnisse für diesen Zeitraum verkünden in einer Pressemitteilung an vor dem Aufruf ausgegeben werden.
ÜBER KERYX BIOPHARMACEUTICALS, INC
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat), ein oral, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat und Form nicht resorbierbare Komplexe zu binden. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit end-stage renal disease an der Dialyse, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug abgeschlossen Administration (FDA) und der New Drug Application Einreichung bei der FDA und der Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) werden bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für das Management von Phosphor und Eisenmangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Kontakt:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
http://finance.yahoo.com/news/...-inc-announces-second-203000961.html
NEW YORK, 31. Juli 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ), ein biopharmazeutisches Unternehmen, das sich auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen (das "Unternehmen") fokussiert , gab heute seine Ergebnisse für das zweite Quartal zum 30. Juni 2013 bestellen.
Am 30. Juni 2013 verfügte das Unternehmen über liquide Mittel, Zinserträge und Wertpapiere von $ 80.400.000, verglichen mit $ 14.700.000 am 31. Dezember 2012 im Vergleich. Am 30. Januar 2013 schloss das Unternehmen einen garantierten öffentlichen Angebot von Stammaktien, die Erlöse der Gesellschaft von ca. 74.800.000 $ zur Verfügung gestellt, nach Abzug von Rabatten und Underwriting bietet Aufwendungen in Höhe von ca. $ 5,6 Millionen Euro. Ebenfalls im Januar 2013 hat die Gesellschaft einen $ 7,0 Mio. Meilensteinzahlung von seinem japanischen Partner für Zerenex (Eisencitrat), Japan Tobacco Inc. ("JT") und Torii Pharmaceutical Co., Ltd ("Torii"), bezogen auf die JT Januar 2013 Einreichung einer New Drug Application ("NDA") mit dem japanischen Ministerium für Gesundheit, Arbeit und Soziales für die Marktzulassung von Eisencitrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung ("CKD").
Der Nettoverlust für das zweite Quartal zum 30. Juni, war 2013 $ 11.400.000 oder $ 0,14 pro Aktie, verglichen mit einem Nettoverlust von $ 1,5 Millionen oder $ 0,02 pro Aktie für das Vergleichsquartal im Jahr 2012, was einem Anstieg der Netto-Verlust von $ 9,9 Millionen. Für das zweite Quartal zum 30. Juni 2013, stiegen die sonstigen Forschung und Entwicklung stiegen um US $ 3,2 Mio. im Vergleich zum zweiten Quartal 2012, vor allem in unseren Zerenex Programm stehen, einschließlich der Vorbereitung der NDA und Marketing Authorization Application ("MAA" ) eingereichten Unterlagen, und andere allgemeine und Verwaltungskosten stiegen um US $ 2,3 Mio. gegenüber dem zweiten Quartal 2012, in erster Linie vor, kommerzielle Aktivitäten im Zusammenhang mit Zerenex Zusammenhang verglichen. Die drei Monate bis zum 30. Juni 2012 enthalten einen nicht zahlungswirksamen außerordentlichen Gewinn von $ 2,6 Mio. im Zusammenhang mit einer Ausbuchung der bedingten Beteiligungsrechte Haftung nach Beendigung der Lizenzvereinbarung für KRX-0401 (perifosine) und eine $ 1.500.000 Schiedsverfahren Auszeichnung, in Zinsen und sonstige Erträge, netto, enthalten, die sich aus einer FINRA Schiedsverfahren gegen eine Broker-Dealer bei der Securities and Exchange Commission registriert. Die drei Monate zum 30. Juni 2013, enthalten $ 0,6 Mio. nicht zahlungswirksame Aufwendungen im Zusammenhang mit Equity Incentive Stipendien.
Der Nettoverlust für die sechs Monate zum 30. Juni, war 2013 $ 13.400.000 oder $ 0,17 pro Aktie, verglichen mit einem Nettoverlust von $ 10,6 Mio. oder $ 0,15 pro Aktie, für den Vergleichszeitraum im Jahr 2012, was einem Anstieg der Netto-Verlust von 2,8 Millionen. Im Januar 2013 wird die Firma einen Umsatz von $ Lizenz 7,0 Mio. für die Meilenstein-Zahlung von seinem japanischen Partner für Zerenex, JT & Torii empfangen, wie oben beschrieben aufgezeichnet. Für die sechs Monate zum 30. Juni 2013, weitere Forschungs-und Entwicklungskosten stiegen um $ 2.300.000 und andere allgemeine und Verwaltungskosten von $ 3,3 Millionen, um die sechs Monate zum 30. Juni gegenüber 2012 angestiegen ist, vor allem auf die Zulassungsanträge und Pre Zusammenhang kommerziellen Tätigkeiten oben diskutiert. Die sechs Monate zum 30. Juni 2012 umfasste die nicht zahlungswirksamen außerordentlichen Gewinn von $ 2,6 Mio. bzw. $ 1.500.000 Schiedsspruch, auch oben diskutiert. Die sechs Monate zum 30. Juni 2013, enthalten $ 1,2 Millionen unbare Aufwendungen im Zusammenhang mit Equity Incentive Stipendien.
Ron Bentsur, den Chief Executive Officer, sagte: "In den vergangenen Monaten haben wir viel von unserer Bemühungen in Richtung der anstehenden Zulassungsantrag, in Kürze erwartet, die einen bedeutenden Meilenstein für Keryx vertreten wird fokussiert. Darüber hinaus mit der bevorstehenden Fertigstellung der US-Phase-2-Studie und der CKD MAA Einreichung in Europa, wir freuen uns auf ein ereignisreiches zweiten Hälfte des Jahres. "
Die Gesellschaft wird eine Telefonkonferenz für Investoren morgen, am Donnerstag, den 1. August 2013 um 8:30 Uhr EDT Gastgeber, der Gesellschaft im zweiten Quartal finanziellen Ergebnisse zu diskutieren und eine Geschäftsaussichten für den Rest des Jahres 2013.
Um an der Telefonkonferenz teilzunehmen, rufen Sie bitte [1-877-869-3847 (USA), 1-201-689-8261] (außerhalb der USA), Call-In-ID: KERYX. Die Audio-Aufzeichnung der Telefonkonferenz zur Verfügung stehen für die Wiedergabe auf http://www.keryx.com , für einen Zeitraum von 15 Tagen nach der Telefonkonferenz.
ÜBER KERYX BIOPHARMACEUTICALS, INC
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat), ein oral, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat und Form nicht resorbierbare Komplexe zu binden. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit end-stage renal disease an der Dialyse, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug abgeschlossen Administration (FDA) und der New Drug Application Einreichung bei der FDA und der Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) werden bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für das Management von Phosphor und Eisenmangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Warnhinweis
Einige der Aussagen in dieser Pressemitteilung enthalten möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Ungewissheiten in sich bergen sein. Bei diesen Aussagen, dass wir den Schutz des sicheren Hafens für die Zukunft gerichteten Aussagen in dem Private Securities Litigation Reform Act von 1995 enthalten. Die Faktoren, aufgrund derer unsere tatsächlichen Ergebnisse wesentlich abweichen, werden von Zeit zu Zeit in unseren Berichten an die Securities and Exchange Commission eingereicht wurden identifiziert. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung sprechen nur ab dem Datum dieser Pressemitteilung. Wir beabsichtigen nicht, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser Pressemitteilung eintreten reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar unter http://www.keryx.com . Die Informationen auf unserer Website ist nicht durch Bezugnahme in diese Pressemitteilung aufgenommen worden und wird als inaktiv textuelle Referenz nur enthalten.
Kontakt:
KERYX CONTACT:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
http://finance.yahoo.com/news/...nces-drug-application-123000887.html
NEW YORK, 8. August 2013 / PRNewswire / - Keryx Biopharmaceuticals, Inc. ( KERX ) gab heute die Einreichung einer New Drug Application (NDA) bei der US Food and Drug Administration (FDA) eine Zulassung für die Vermarktung und den Verkauf von Zerenex ™ (Eisencitrat Koordination Komplex), der Gesellschaft Wirkstoffkandidaten zur Behandlung von erhöhten Serum-Phosphat-Spiegel, oder Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung (CKD) an der Dialyse. Die Gesellschaft NDA-Antrag ist in erster Linie auf den Datensätzen aus der Phase-3-Programm, das im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung wurde durchgeführt mit der FDA basiert, und wird auch von Wirksamkeit und Sicherheit von Daten aus mehreren weiteren Studien, einschließlich unterstützter vier Studien der Phase 3 in Japan bei CKD-Patienten an der Dialyse durchgeführt.
Ron Bentsur, den Chief Executive Officer, sagte: "Die Einreichung des Zerenex NDA ist ein wichtiger Meilenstein für das Unternehmen. Mit rund 1.500 Patienten, die das Medikament in der klinischen Entwicklungsprogramme von uns und unseren japanischen Partner, JT / Torii durchgeführt glauben wir, dass Zerenex eine sichere, effektive und hoch differenzierte Wirkstoffkandidaten und die heutige Einreichung bringt uns einen Schritt näher zu bringen potenziell dieses Medikament für Patienten, die davon profitieren können. " Mr. Bentsur weiter: "Wir sind dankbar, dass Dr. Julia Lewis, die Study Professur für Zerenex Programm der Phase 3, und unsere hoch qualifizierten internen Team von klinischen, Herstellung und regulatorische Profis, für die Zeit und Mühe, die sie in diese Richtung gewidmet haben enorme Leistung. "
Das Unternehmen plant auch, eine Marketing Authorization Application (MAA) bei der Europäischen Arzneimittelagentur (EMA) einreichen für die behördliche Zulassung von Zerenex in der Europäischen Union.
Keryx hält eine weltweite Lizenz (außer für bestimmte asiatisch-pazifischen Ländern) zu Zerenex von Panion & BF Biotech, Inc. Die japanischen Rechte Unterlizenz von Keryx zu Japan Tobacco Inc. (JT) und Torii Pharmaceutical Co., Ltd (Torii). Am 7. Januar 2013, kündigte JT die Einreichung seines NDA mit dem japanischen Ministerium für Gesundheit, Arbeit und Wohlfahrt für die Marktzulassung von Eisencitrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit CKD.
Zerenex ist auch in Phase 2 der Entwicklung in den USA für das Management von Phosphor und Eisenmangel bei anämischen Patienten mit Stufe 3 zu 5 nicht-Dialyse abhängig CKD.
Über Special Protocol Assessments
Die Special Protocol Assessment (SPA)-Prozess ist ein Verfahren, mit dem die FDA stellt offizielle Auswertung und schriftliche Anleitungen auf die Gestaltung und Größe der vorgeschlagenen Protokolle, soll die Grundlage für ein neues Medikament Anwendung bilden. Endgültige Zulassung hängt von der Wirksamkeit und Sicherheit Ergebnisse, einschließlich der Nebenwirkungsprofil, und eine Bewertung des Nutzen / Risiko der Behandlung in der klinischen Phase-3-Programm gezeigt. Die SPA Vereinbarung kann nur durch eine schriftliche Vereinbarung zwischen dem Sponsor und dem FDA geändert werden, oder wenn die FDA Kenntnis von einer erheblichen wissenschaftlichen Fragestellung wichtig, Produkt Wirksamkeit oder Sicherheit. Für weitere Informationen über Special Protocol Assessment, bitte
Über Hyperphosphatämie
In den Vereinigten Staaten, nach Daten aus dem US Renal Data System, gibt es etwa 630.000 Patienten mit chronischer Nierenerkrankung Stufe 5, die auch als End Stage Renal Disease (ESRD) bezeichnet wird, und die Anzahl der CKD-Phase 5 Patienten wird projiziert steigen in die Zukunft. Die Mehrheit der CKD-Phase 5 Patienten in den Vereinigten Staaten, über 400.000, Dialyse benötigen. Diese Patienten werden als CKD-Patienten an der Dialyse bezeichnet.
Weltweit gibt es etwa 2,8 Millionen Patienten mit CKD Stufe 5, mit der Mehrheit von solchen Patienten, über 2 Millionen, eine Dialyse benötigen. Phosphat-Retention und die daraus resultierende Hyperphosphatämie bei CKD-Patienten an der Dialyse sind in der Regel mit sekundärem Hyperparathyreoidismus, Nierenosteodystrophie, Weichteil-Mineralisierung und das Fortschreiten der Niereninsuffizienz. CKD-Patienten an der Dialyse in der Regel eine Behandlung mit Phosphat-Bindemittel zu senken und zu pflegen Serum-Phosphor auf einem akzeptablen Niveau. Der Bedarf an alternativen Phosphat-Bindemittel ist seit langem bekannt, vor allem angesichts der zunehmenden Verbreitung von Dialyse sowie Mängel mit aktuellen Therapien. Zerenex hat das Potenzial, eine wirksame und sichere Behandlung bei der Senkung und / oder Aufrechterhaltung der normalen Serumphosphorspiegel bei CKD-Patienten auf Dialyse.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat Koordination Komplex), ein orales, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat binden und nicht resorbierbare Komplexe hat. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit chronischer Nierenerkrankung auf Dialyse abgeschlossen, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration ( FDA), und das Unternehmen hat eine New Drug Application bei der FDA eingereicht. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) wird bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für das Management von Phosphor und Eisenmangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Warnhinweis
Einige der Aussagen in dieser Pressemitteilung, insbesondere in Bezug auf die Ergebnisse der klinischen Studien, die klinischen Vorteile von Zerenex (Eisencitrat Koordination Komplex), Zulassungsanträge und Zulassungen, die kommerziellen Chancen und wettbewerbsfähige Positionierung abgeleitet werden einbezogen, und jedes Unternehmen Aussichten für Zerenex, möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Ungewissheiten in sich bergen sein. Bei diesen Aussagen, dass wir den Schutz des sicheren Hafens für die Zukunft gerichteten Aussagen in dem Private Securities Litigation Reform Act von 1995 enthalten. Unter den Faktoren, die dazu führen, dass unsere tatsächlichen Ergebnisse erheblich abweichen könnten, sind die folgenden: das Risiko, dass die NDA-und MAA-nicht zur Überprüfung durch die FDA und EMA akzeptiert werden, bzw. aufgrund von Mängeln in der Anwendung oder aus anderen Gründen, das Risiko dass die FDA und EMA letztlich verweigern Zustimmung des NDA-und MAA-, bzw. das Risiko, dass Schutzgebiete nicht die Garantie, dass die FDA eine NDA für die Einreichung annehmen oder genehmigen letztlich ein Produkt Kandidaten nach Einreichung, ob die FDA und EMA wird mit stimmen das unsere Interpretation unserer Studie der Phase 3 Ergebnisse oder die Durchführung der Studie, ob, wenn Zerenex erhält Zulassung, wird es erfolgreich vertrieben und vermarktet werden, sowie andere Risikofaktoren, die von Zeit zu Zeit in unseren Berichten an die Securities and Exchange Commission eingereicht wurden identifiziert . Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung sprechen nur ab dem Datum dieser Pressemitteilung. Wir verpflichten uns nicht, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser Pressemitteilung eintreten reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar unter http://www.keryx.com . Die Informationen auf unserer Website, und der FDA-Website gefunden wird, nicht durch Bezugnahme in diese Pressemitteilung aufgenommen und dienen nur als Referenz enthalten.
KERYX CONTACT:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
http://seekingalpha.com/article/...ealthcare-sweet-spots?source=yahoo
Biotech-Unternehmen bieten eine solide langfristige Chance für Investoren, aber arzneimittelrechtlichen Zulassungen immer noch ein Problem für sie. Sie sind in der Entwicklung neuer Medikamente, die ständig durchlaufen werden klinische Studien beteiligt. Die neuen Drogen versorgen, um unerfüllte Bedürfnisse, erstellen Sie eine Marktchance, und bringen in konstanten Einnahmen für diese Unternehmen. Diese Unternehmen auch vor Risiken auf ihre Forschungs-und Entwicklungsausgaben von klinischen Ausfälle und regulatorische Verzögerungen. Drei solche Biotech-Unternehmen entwickeln vielversprechende neue Medikamente. Lassen Sie uns an ihren Fahrplan der Entwicklung zu suchen.
Keryx Biopharmazeutika ( KERX ) entwickelt eine neue Droge namens Zerenex, die für die Behandlung von Dialyse-Patienten, die an einer Nierenerkrankung leiden, eingesetzt werden. Zerenex hat bereits zwei Phase-III-Studien abgeschlossen und vor kurzem für die FDA-Zulassung eingereicht.
Während der Phase-III-Studien, reduziert Zerenex die Verwendung von einigen der Verbindungen, wie 24% weniger Erythropoese-stimulierenden Substanzen oder ESA, und 52% weniger IV-Eisen, während der Dialysebehandlung. Die reduzierte Nutzung dieser Verbindungen könnte bedeuten eine Ersparnis von $ 750 Millionen jährlich für die Dialyse-Zentren. Zerenex wird voraussichtlich genehmigt werden und auf den Markt im Jahr 2014. Laut Fresenius, ein Medizintechnik-Firma, gibt es mehr als 400.000 Dialysepatienten jeweils in den USA und der EU, und Keryx erwartet einen kombinierten Umsatz von $ 500 Millionen pro Jahr aus den USA und der EU im Jahr 2014.
Für die weitere Entwicklung und Vermarktung von Zerenex in den USA hat Keryx die Droge selbst gehalten, während es in Japan sub-lizenziert, um die Entwicklung JT und Torii Pharmaceutical (hat TRXPF.PK ) oder JTT. Im Rahmen der Vereinbarung hat JTT zu Lizenzgebühren und bestimmte Zahlungen auf den Fortschrittsbericht der Zulassung von Arzneimitteln mit Sitz in Japan zahlen. Als Ergebnis hat Keryx eine Zahlung von $ 7.000.000 aus JTT im Zusammenhang mit der Beantragung der Zulassung mit dem japanischen Ministerium erhalten. Darüber hinaus wird JTT Lizenzzahlungen an Keryx bei einem Nettoumsatz von Zerenex machen. Keryx hat 35.000.000 $-up-to date von JTT erhalten. Es gibt etwa 304.000 Dialysepatienten in Japan, und der erwartete Cashflow Keryx wird 10 Millionen Dollar in 2014 und 28 Millionen Dollar 2015. Dies ist wesentlich für Keryx, denn dies ist die einzige Einnahmequelle für das Unternehmen, bis es Zerenex startet. Die Zulassung seines Medikaments wird erwartet, dass die EPS zu einem positiven Wert von $ 0,44 im Jahr 2015 nehmen von negativen $ 0,32 im Jahr 2012.
http://finance.yahoo.com/news/...es-upcoming-corporate-123000385.html
NEW YORK, 4. September 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ) gab heute bekannt, dass Ron Bentsur, den Chief Executive Officer, wird bei den folgenden kommenden Gesundheitswesen Investoren-Konferenzen präsentieren:
Rodman & RENSHAW 15 th Annual Global Investment Conference
Präsentation Datum: Montag, 9. September 2013
Presentation Time: 10.00 Uhr ET
Stifel Nicolaus Healthcare Conference 2013
Präsentation Datum: Donnerstag, 12. September 2013
Presentation Time: 15.50 Uhr ET
Jede dieser Präsentationen werden Live-Audio-Webcast und zugänglich von der Investor Informationsseite der Website des Unternehmens unter sein http://investors.keryx.com . Eine archivierte Version des Webcast wird jedem zur Verfügung stehen nach Abschluss der Live-Präsentation.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat Koordination Komplex), ein orales, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat binden und nicht resorbierbare Komplexe hat. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit chronischer Nierenerkrankung auf Dialyse abgeschlossen, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration ( FDA), und das Unternehmen hat eine New Drug Application bei der FDA eingereicht. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) wird bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für das Management von Phosphor und Eisenmangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Kontakt:
KERYX CONTACT:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
Title§Keryx Biopharmaceuticals, Inc. at Stifel Nicolaus Weisel Healthcare Conference
Date and Time Thursday, September 12, 2013 3:50 p.m. ET
Location§Four Seasons Hotel
Boston, MA US
http://investors.keryx.com/...etails&c=122201&eventID=5017711
Presentation Scheduled for Friday, September 27th at 3:00 p.m. ET
http://finance.yahoo.com/news/...iocenturys-newsmakers-123000812.html