Das könnte abgehen....
Seite 41 von 44 Neuester Beitrag: 24.04.21 23:50 | ||||
| Eröffnet am: | 30.01.09 11:58 | von: Touwse | Anzahl Beiträge: | 2.094 |
| Neuester Beitrag: | 24.04.21 23:50 | von: Franziskasha. | Leser gesamt: | 116.385 |
| Forum: | Hot-Stocks | Leser heute: | 28 | |
| Bewertet mit: | ||||
| Seite: < 1 | ... | 38 | 39 | 40 | | 42 | 43 | 44 > | ||||
https://www.kompany.de/c/de/hrb17626%20stendal
Former Global General Manager, Senior Vice President of the Renal Franchise at Genzyme (Sanofi) Brings Key Renal Commercialization Expertise to Keryx
Daniel P. Regan, 49, tritt in die Keryx Board of Directors mit breiten pharmazeutischen Führungserfahrung im gesamten Spektrum der globalen Vermarktung, Vertrieb und Marketing von neuartigen Therapien zur Behandlung von Patienten mit chronischer Nierenerkrankung. Von 1999 bis 2011 hielt Herr Regan Positionen mit zunehmender Verantwortung bei Genzyme / Sanofi ( SNY ) führenden multi-funktionale Teams in Vertrieb, Marketing und Kommerzialisierung der renalen Produkte. Herr Regan Karriere bei Genzyme inklusive seiner Ernennung zum Global General Manager Senior Vice President der Renal Franchise, wo er direkt verantwortlich für alle Aspekte der weltweiten Nieren kommerziellen Transaktionen, einschließlich der Renagel (R) / Renvela (R) Phosphatbinder Franchise und die weltweite Einführung von Renvela (R), wächst die renale Franchise globalen Umsatz nähert sich 1 Milliarde Dollar. Herr Regan ist derzeit Chief Commercial Officer von Intercept Pharmaceuticals ( ICPT ). Von 2011 bis 2012 war Herr Regan als Chief Commercial Officer von Inspiration Biopharmaceuticals, die ihre wichtigste Ressource, um Baxter International verkauft. Herr Regan hat einen BA-Abschluss in Wirtschaftswissenschaften von der University of Massachusetts.
"Wir sind sehr erfreut, dass Dan Regan unseren Board of Directors", sagte Ron Bentsur, den Chief Executive Officer. "Dan bringt enorme Kommerzialisierung Erfahrung und eine Fülle von Wissen in der renalen Raum. Wir freuen uns darauf, seine Expertise zur möglichen Einführung von Zerenex TM (Eisencitrat Koordination Komplex), unsere Wirkstoffkandidaten für die Behandlung von Hyperphosphatämie bei Dialysepatienten. "
http://finance.yahoo.com/news/...als-zerenex-tm-ferric-123000966.html
NEW YORK, 17. Oktober 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. (Nasdaq: KERX) gab heute bekannt, dass Abstracts Hervorhebung Zerenex (TM) (Eisencitrat Koordination Komplex), der Gesellschaft Wirkstoffkandidaten zur Behandlung von erhöhten Serum Phosphat-Spiegel, oder Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung (CKD) an der Dialyse, haben für Vorträge und Poster wurden in der amerikanischen Gesellschaft für Nephrologie (ASN) Kidney Week 2013 Jahresversammlung gewählt. Dieses jährliche Treffen der ASN wird in Atlanta, Georgia, von November 5-10, 2013 statt.
Zusammenfassung Zerenex (TM) (Eisencitrat Koordination komplexer) Daten-Darstellungen:
Mündliche Präsentation:
Samstag, 9. November:
Abstract #: SA-OR083
- Titel: Eisencitrat, Phosphatbinder, Erhöht Eisenspeicher ist aber nicht mit Nachweis der Unterernährung-Entzündung-Kachexie-Syndrom
- Session Name: Dialyse: Anämie, Entzündung, Unterernährung, und Stoffwechsel
- Presentation Time: 05.30 Uhr
KLINISCHE Poster-Präsentationen:
DONNERSTAG, 7. November:
Abstract #: TH-PO521
- Titel: Eisencitrat als Phosphatbinder Verringert IV Eisen und Erythropoietin stimulierendes Mittel (ESA) Verwendung
- Session Name: Dialyse: Anämie, Entzündung, Unterernährung, & Metabolism - I
- Präsentation Zeit: 10.00 Uhr
Samstag, 9. November:
Abstract #: SA-PO382
- Titel: Erreicht Eisenspeicher und die klinischen Ergebnisse in einem Trial of Eisencitrat als Phosphatbinder
- Session Name: Dialyse: Anämie, Entzündung, Unterernährung, & Metabolism - II
- Präsentation Zeit: 10.00 Uhr
Abstract #: SA-PO540
- Titel: Eisencitrat als Phosphatbinder Hat ein ähnliches Sicherheitsprofil wie Sevelamercarbonat und Calcium Acetate
- Session Name: Mineral Disease: CKD-MBD - II
- Präsentation Zeit: 10.00 Uhr
Abstract #: SA-PO542
- Titel: Eisencitrat Wird Phosphor, Eisen liefert, und reduziert IV Iron and Erythropoetische stimulierendes Mittel Use in End-Stage Renal Disease
- Session Name: Mineral Disease: CKD-MBD - II
- Präsentation Zeit: 10.00 Uhr
Abstract #: SA-PO543
- Titel: Auswirkungen von Eisen-III-Citrat, ein Oral Phosphate Binder, auf Mineral-und Knochenstoffwechsel-Marker in der Dialyse
- Session Name: Mineral Disease: CKD-MBD - II
- Präsentation Zeit: 10.00 Uhr
Darüber hinaus wurde ein Auszug aus der Gesellschaft japanischen Partner für Zerenex, Japan Tobacco, Inc., im Zusammenhang mit seiner Phase 3, multizentrische, randomisierte, doppel-blinde, Placebo-kontrollierte Studie in nicht-Dialyse abhängig japanischen Patienten mit CKD, auch akzeptiert für Poster-Präsentation im Rahmen der Jahrestagung:
Abstract #: SA-PO544
- Titel: Die Wirkung von JTT-751 (Eisencitrat Hydrate) on Phosphorus und FGF-23 in Chronic Kidney Disease
- Session Name: Mineral Disease: CKD-MBD - II
- Präsentation Datum / Zeit: Samstag, 9. November, 10.00 Uhr
Die oben genannten Abstracts sind derzeit online verfügbar für die Anzeige durch den ASN-Website unter: http://www.asn-online.org/education/kidneyweek/archives/ .
Keryx hält eine weltweite Lizenz (außer für bestimmte asiatisch-pazifischen Ländern) zu Zerenex (Eisencitrat Koordination Komplex) von Panion & BF Biotech, Inc. Die japanischen Rechte Unterlizenz von Keryx zu Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat Koordination Komplex), ein orales, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat binden und nicht resorbierbare Komplexe hat. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit chronischer Nierenerkrankung auf Dialyse abgeschlossen, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration ( FDA) und der Gesellschaft New Drug Application wird derzeit von der FDA geprüft. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) wird bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für die Verwaltung der erhöhten Phosphor und Eisen-Mangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Warnhinweis
Einige der Aussagen in dieser Pressemitteilung, insbesondere in Bezug auf die Ergebnisse der klinischen Studien, die klinischen Vorteile von Zerenex (Eisencitrat Koordination Komplex), Zulassungsanträge und der Zeitpunkt einer solchen Überprüfung, Genehmigungen, die kommerziellen Möglichkeiten abgeleitet werden einbezogen und Positionierung im Wettbewerb, und alle Geschäftsaussichten für Zerenex, möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Ungewissheiten in sich bergen sein. Bei diesen Aussagen, dass wir den Schutz des sicheren Hafens für die Zukunft gerichteten Aussagen in dem Private Securities Litigation Reform Act von 1995 enthalten. Unter den Faktoren, die dazu führen, dass unsere tatsächlichen Ergebnisse erheblich abweichen könnten, sind die folgenden: die Annahme der NDA-Antrag stellen keine abschließende Bewertung der Eignung der Daten in der NDA eingereicht; ob die FDA die Überprüfung des NDA rechtzeitig abzuschließen Basis, das Risiko, dass die FDA, EMA, und japanische Ministerium für Gesundheit, Arbeit und Wohlfahrt letztlich verweigern Zustimmung der US-NDA, MAA und japanischer NDA, bzw. das Risiko, dass Schutzgebiete nicht eine Garantie, dass die FDA genehmigt wird letztlich ein Produkt Kandidaten nach Einreichung Akzeptanz; ob Zerenex, wenn er angenommen wird erfolgreich eingeführt und vermarktet werden;; und andere Risikofaktoren, ob die FDA und EMA mit unserer Interpretation unserer Phase-3-Studie Ergebnisse, unterstützende Daten oder die Durchführung der Studien stimmen identifiziert von Zeit zu Zeit in unseren Berichten an die Securities and Exchange Commission eingereicht wurde. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung sprechen nur ab dem Datum dieser Pressemitteilung. Wir verpflichten uns nicht, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser Pressemitteilung eintreten reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar unter www.keryx.com . Die Informationen auf unserer Website und auf der ASN Website wird nicht durch Bezugnahme in diese Pressemitteilung aufgenommen worden und wird als inaktiv textuelle Referenz nur enthalten.
Kontakt:
KERYX CONTACT:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
http://www.keryx.com/convention-schedule/
American Society of Nephrology, Kidney Week, Atlanta, Georgia
November 5-11 2013
14.35 21.10.13
Keryx Biopharmaceuticals , Inc.
21.10.2013 14.30 Uhr
http://www.ariva.de/news/...r-Zerenex-TM-New-Drug-Application-4809590
NEW YORK, 2013-10-21 14.30 CEST (GLOBE NEWSWIRE) -
Keryx Biopharmaceuticals , Inc. (Nasdaq: KERX ) gab heute bekannt, dass die US Food
and Drug Administration (FDA) eine Prescription Drug User Fee Act ( PDUFA ) zugeordnet
Ziel Datum vom 7. Juni 2014, für die Gesellschaft New Drug Application (NDA) für
Zerenex (TM) ( Eisencitrat Koordination Komplex) , der Gesellschaft Wirkstoffkandidaten
für die Behandlung von erhöhten Serum- Phosphat-Spiegel , oder Hyperphosphatämie , in
Patienten mit chronischer Nierenerkrankung ( CKD) an der Dialyse .
Über Keryx Biopharmaceuticals , Inc.
Keryx Biopharmazeutika auf der Akquisition, Entwicklung und konzentriert
Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die
Behandlung der Nierenerkrankung . Keryx entwickelt Zerenex ( Eisencitrat
Koordination Komplex) , ein orales , Eisen auf Eisen basierenden Verbindung, die das hat Kapazität , Phosphat zu binden und nicht resorbierbaren Komplexe . Keryx hat
absolvierte eine US-amerikanische klinische Phase-3 -Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel ) bei Patienten mit chronischer Nierenerkrankung auf Dialyse , durchgeführt im Rahmen eines Special Protocol Assessment (SPA ) Vereinbarung mit der Food and Drug Administration (FDA ) und der Gesellschaft New Drug Application wird derzeit von der FDA geprüft . Der Marketing- Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) ist bis zur Vorlage . Zerenex ist auch in Phase 2 der Entwicklung in den USA für die Verwaltung der erhöhten Phosphor und Eisen -Mangel bei anämischen Patienten mit Stages 3-5 Nicht- Dialyse abhängig chronischen Nierenerkrankungen . Zusätzlich Keryx japanischen Partner , Japan Tobacco Inc. und Torii Pharmaceutical Co. , Ltd eingereicht hat seine New Drug Application für die Marktzulassung von Eisencitrat in
Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischen Nierenerkrankungen Krankheit. Keryx ist in New York City ansässig .
Warnhinweis
Einige der Aussagen in dieser Pressemitteilung , insbesondere solche enthalten
in Bezug auf die Ergebnisse der klinischen Studien , um die klinischen Vorteile abgeleitet werden von Zerenex ( Eisencitrat Koordination Komplex) , Zulassungsanträge und der Zeitpunkt einer solchen Überprüfung , Genehmigungen, die kommerziellen Chancen und Positionierung im Wettbewerb , und alle Geschäftsaussichten für Zerenex , kann zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Ungewissheiten in sich bergen . Bei diesen Aussagen , dass wir den Schutz des sicheren Hafens für zukunftsgerichtete Aussagen im Private Securities Litigation enthalten Reform Act von 1995. Unter den Faktoren, die dazu führen, dass unsere tatsächlichen Ergebnisse könnten abweichen, sind die folgenden: die Annahme der NDA-Antrag stellt nur eine vorläufige Beurteilung der Anwendung und ist kein Hinweis auf Mängel , die während der FDA Überprüfung identifiziert werden können , ein Ziel PDUFA Datum ist freibleibend und garantiert nicht, dass die Überprüfung des NDA werden abgeschlossen zeitnah , das Risiko , dass die FDA , EMA , und / oder die japanische Ministerium für Gesundheit, Arbeit und Wohlfahrt letztlich verweigern Zustimmung der US- NDA , MAA und / oder japanischen NDA , bzw. das Risiko, dass Schutzgebiete nicht ein garantieren, dass die FDA genehmigt wird letztlich ein Produkt Kandidat folgende Einreichung Akzeptanz ; ob die FDA und EMA wird mit unserer Interpretation überein unserer Phase- 3-Studie Ergebnisse , unterstützende Daten oder die Durchführung der Studien ; ob Zerenex , wenn er angenommen wird erfolgreich eingeführt und vermarktet werden , und andere Risikofaktoren, die von Zeit zu Zeit identifiziert in unseren Berichten an die eingereicht Securities and Exchange Commission . Alle zukunftsgerichteten Aussagen dargelegt in Diese Pressemitteilung sprechen nur ab dem Datum dieser Pressemitteilung . Wir tun nicht verpflichten sich, diese zukunftsgerichteten Aussagen zu aktualisieren , um Ereignisse widerspiegeln
oder Umstände , die nach dem Datum dieser Pressemitteilung eintreten . Diese Pressemitteilung und vor Veröffentlichungen sind verfügbar unter http://www.keryx.com . Die Informationen auf unserer gefunden Website und der FDA-Website , wird nicht durch Bezugnahme in dieser Pressemitteilung enthalten loslassen und dienen nur als Referenz enthalten.
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals , Inc.
Tel.: 212.531.5965
E- mail: lfischer@keryx.com
News Source: NASDAQ OMX
21.10.2013 Veröffentlichung einer Corporate News, übermittelt durch die DGAP -
ein Unternehmen der EQS Group AG.
Das ist der Emittent verantwortlich für den Inhalt dieser Bekanntmachung .
Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten,
Corporate News / Finanznachrichten und Pressemitteilungen.
Medienarchiv unter www.dgap -medientreff.de und www.dgap.de
-------------------------------------------------- -------------------------
Sprache: Englisch
Firma: Keryx Biopharmaceuticals , Inc.
Vereinigte Staaten von Amerika
Telefon:
Fax:
E- mail:
Internet:
ISIN: US4925151015
WKN:
Ende der Mitteilung DGAP News-Service
http://finance.yahoo.com/news/...rice-target-raised-16-123158739.html
Maxim hob das Kursziel für Keryx nachdem die FDA eine Aktion gesetzt Termin für Zerenex des Unternehmens Wirkstoffkandidaten zur Behandlung von erhöhten Serum-Phosphat-Spiegel. Das Unternehmen hält eine Kaufempfehlung für die Aktie.
08.18 EDT KERX Keryx Kursziel angehoben, um 22 $ ab $ 14 an JMP Securities
JMP Securities erhöht das Kursziel auf Keryx wie das Unternehmen hob seine Umsatzprognose für das Unternehmen Zerenex - ein Medikament zur Behandlung erhöhten Serum-Phosphat-Spiegel bei Patienten mit chronischer Nierenerkrankung - basierend auf aktuellen Daten. Das Unternehmen bekräftigt ein Outperform Rating für die Aktie.
http://www.theflyonthewall.com/permalinks/...from---at-JMP-Securities
http://finance.yahoo.com/news/...s-inc-announces-third-213000851.html
NEW YORK, 4. November 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ), ein biopharmazeutisches Unternehmen, das sich auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen (die "Gesellschaft" konzentriert ), gab heute seine Ergebnisse für das dritte Quartal zum 30. September 2013 bestellen.
Am 30. September 2013 hatte die Gesellschaft Zahlungsmittel, Zahlungsmitteläquivalente und Zinsforderungen von $ 67.900.000, verglichen mit $ 14.700.000 am 31. Dezember 2012 im Vergleich. Im Juli 2013 hat die Gesellschaft einen $ 2,0 Mio. (New Drug Application "NDA") Nutzungsentgelt im Zusammenhang mit der Vorlage seiner NDA-Antrag bei der Food and Drug Administration ("FDA"). Im Oktober 2013 erhielt das Unternehmen eine volle Rückerstattung des $ 2,0 Million NDA Nutzungsentgelt nach Eingang eines Verzichts unter den kleinen Unternehmen Waiver-Regelung des Federal Food, Drug, and Cosmetic Act gewährt. Am 30. Januar 2013 schloss das Unternehmen einen garantierten öffentlichen Angebot von Stammaktien, die Erlöse der Gesellschaft von ca. 74.800.000 $ zur Verfügung gestellt, nach Abzug von Rabatten und Underwriting bietet Aufwendungen in Höhe von ca. $ 5,6 Millionen Euro. Ebenfalls im Januar 2013 hat die Gesellschaft einen $ 7,0 Mio. Meilensteinzahlung von seinem japanischen Partner für Zerenex (Eisencitrat Koordination komplexer), Japan Tobacco Inc. ("JT") und Torii Pharmaceutical Co., Ltd ("Torii"), bezogen um JT Januar 2013 Einreichung einer NDA mit dem japanischen Ministerium für Gesundheit, Arbeit und Wohlfahrt für die Marktzulassung von Eisencitrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung ("CKD").
Der Nettoverlust für das Quartal zum 30. September war 2013 $ 15.700.000 oder $ 0,19 pro Aktie, verglichen mit einem Nettoverlust von $ 5,5 Mio. oder $ 0,08 pro Aktie für das Vergleichsquartal im Jahr 2012, was einem Anstieg der Netto-Verlust von $ 10.200.000 . Für das dritte Quartal zum 30. September 2013, stiegen die sonstigen Forschung und Entwicklung stiegen um US $ 6,6 Mio. im Vergleich zum dritten Quartal 2012, vor allem auf die Gesellschaft Zerenex Programm stehen, einschließlich der Kosten mit der Einreichung der NDA verbunden, Vorbereitung der Marketing Authorization Application ("MAA") Einreichung und Herstellung von Pre-Launch-Inventar und Kapazitätserweiterung. Die drei Monate zum 30. September 2013, eine einmalige $ 1,0 Mio. Meilensteinzahlung an den Lizenzgeber von Zerenex, im Zusammenhang mit der Gesellschaft die Einreichung des Zulassungsantrags im August 2013. Andere allgemeine und Verwaltungskosten im dritten Quartal 2013 um $ 3,4 Mio. gegenüber dem dritten Quartal 2012, in erster Linie vor, kommerzielle Aktivitäten im Zusammenhang mit Zerenex Zusammenhang verglichen. Die drei Monate bis 30. September 2013, enthalten $ 0,7 Mio nicht zahlungswirksame Aufwendungen im Zusammenhang mit Equity Incentive Stipendien.
Der Nettoverlust für die neun Monate zum 30. September, war 2013 $ 29.100.000 oder $ 0,36 pro Aktie, verglichen mit einem Nettoverlust von $ 16.100.000 oder $ 0,22 pro Aktie, für den Vergleichszeitraum im Jahr 2012, was einem Anstieg der Netto-Verlust von $ 13,0 Millionen. Im Januar 2013 wird die Firma einen Umsatz von $ Lizenz 7,0 Mio. für die Meilenstein-Zahlung von seinem japanischen Partner für Zerenex, JT & Torii empfangen, wie oben beschrieben aufgezeichnet. Für die neun Monate zum 30. September 2013, stiegen die sonstigen Forschungs-und Entwicklungskosten von $ 8.900.000 und andere allgemeine und Verwaltungskosten von $ 6,7 Millionen, um die neun Monate zum 30. September gegenüber 2012, vor allem auf die Zulassungsanträge im Zusammenhang erhöht, Herstellung Inventar, diskutiert einmalige Meilensteinzahlung und pre-kommerzielle Aktivitäten über. Die neun Monate zum 30. September 2012 enthalten einen nicht zahlungswirksamen außerordentlichen Gewinn von $ 2,6 Mio. im Zusammenhang mit einer Ausbuchung der bedingten Beteiligungsrechte Haftung nach Beendigung der Lizenzvereinbarung für KRX-0401 (perifosine) und eine $ 1.500.000 Schiedsverfahren Auszeichnung, in Zinsen und sonstige Erträge, netto, enthalten, die sich aus einer FINRA Schiedsverfahren gegen eine Broker-Dealer bei der Securities and Exchange Commission registriert. Die neun Monate zum 30. September 2013, enthalten $ 2,0 Mio. nicht zahlungswirksame Aufwendungen im Zusammenhang mit Equity Incentive Stipendien.
Ron Bentsur, den Chief Executive Officer, sagte: "Die letzten Monate waren sehr spannend für das Unternehmen. Wir reichten die Zerenex NDA, die Einreichung wurde nun von der FDA zur Überprüfung angenommen worden und wurde ein PDUFA Ziel Datum zugewiesen vom 7. Juni 2014. Darüber hinaus haben wir aktiv den Aufbau unserer kommerziellen Infrastruktur mit erfahrenen Profis in der Dialyse und chronischer Nierenerkrankung therapeutischen Bereichen, um die erwartete Markteinführung Mitte 2014 zu unterstützen. "
ÜBER KERYX BIOPHARMACEUTICALS, INC
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat Koordination Komplex), ein orales, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat binden und nicht resorbierbare Komplexe hat. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit chronischer Nierenerkrankung auf Dialyse abgeschlossen, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration ( FDA). Die Gesellschaft New Drug Application (NDA) wird derzeit von der FDA mit einer zugeordneten Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) wird bis zur Vorlage. Zerenex ist auch in Phase 2 der Entwicklung in den USA für die Verwaltung der erhöhten Phosphor und Eisen-Mangel bei anämischen Patienten mit Stages 3-5 Nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Warnhinweis
Einige der Aussagen in dieser Pressemitteilung, insbesondere in Bezug auf die Ergebnisse der klinischen Studien, die klinischen Vorteile von Zerenex (Eisencitrat Koordination Komplex), Zulassungsanträge und der Zeitpunkt einer solchen Überprüfung, Genehmigungen, die kommerziellen Möglichkeiten abgeleitet werden einbezogen und Positionierung im Wettbewerb, und alle Geschäftsaussichten für Zerenex, möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Ungewissheiten in sich bergen sein. Bei diesen Aussagen, dass wir den Schutz des sicheren Hafens für die Zukunft gerichteten Aussagen in dem Private Securities Litigation Reform Act von 1995 enthalten. Unter den Faktoren, die dazu führen, dass unsere tatsächlichen Ergebnisse erheblich abweichen könnten, sind die folgenden: die Annahme der NDA-Antrag stellt nur eine vorläufige Beurteilung der Anwendung und ist kein Hinweis auf Mängel, die während der FDA Überprüfung identifiziert werden können; ein PDUFA Zieldatum unterliegt zu ändern und garantiert nicht, dass die Überprüfung des NDA zeitnah abgeschlossen werden, das Risiko, dass die FDA, EMA, und / oder das japanische Ministerium für Gesundheit, Arbeit und Wohlfahrt letztlich verweigern Zustimmung der US-NDA, MAA und / oder japanischen NDA, bzw. das Risiko, dass Schutzgebiete nicht eine Garantie, dass die FDA genehmigt wird letztlich ein Produkt Kandidaten nach Einreichung Akzeptanz; ob die FDA und EMA mit unserer Interpretation unserer Phase-3-Studie Ergebnisse, unterstützende Daten oder den stimmen Durchführung der Studien, ob Zerenex, wenn er angenommen wird erfolgreich eingeführt und vermarktet werden, sowie andere Risikofaktoren, die von Zeit zu Zeit in unseren Berichten identifiziert bei der Securities and Exchange Commission. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung spricht nur ab dem Datum dieser Pressemitteilung. Wir verpflichten uns nicht, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser Pressemitteilung eintreten reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar unter http://www.keryx.com . Die Informationen auf unserer Website zu finden ist nicht durch Bezugnahme in diese Pressemitteilung aufgenommen und dienen nur als Referenz enthalten.
Kontakt:
KERYX CONTACT:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
http://finance.yahoo.com/news/...-hold-conference-call-220000953.html
NEW YORK, 4. November 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX wird) eine Telefonkonferenz abhalten, morgen, Dienstag, den 5. November 2013 um 8:30 Uhr ET, um die Top-Line-Ergebnisse aus der Prüfung Phase-2-Studie von Zerenex (TM) (Eisencitrat Koordination Komplex) in Nicht-Dialyse abhängig chronischen Nierenerkrankung Patienten mit erhöhten Serum-Phosphor und Eisenmangelanämie. Keryx verkünden die Top-Line-Ergebnisse morgen früh, vor dem Aufruf.
Ron Bentsur, Chief Executive Officer von Keryx, werden die Telefonkonferenz. Geoffrey A. Block, MD, Direktor der Klinischen Forschung in Denver Nephrologie, Glenn Chertow, MD, Leiter der Abteilung für Nephrologie und Professor für Medizin an der Stanford University School of Medicine, und Steven Fishbane, MD, Leiter der Abteilung für Nephrologie, Vice President von North Shore-LIJ Health System für Network Dialysedienstleistungen und Direktor der Klinischen Forschung an der North Shore-LIJ Department of Medicine, Co-Vorsitzende der Phase-2-Studie, wird ebenfalls an das Gespräch.
Neben der Bekanntgabe der Top-Line-Ergebnisse wird das Unternehmen kurz auf das Unternehmen im dritten Quartal des Geschäftsjahres und eine Geschäftsaussichten für den Rest des Jahres 2013.
Um an der Telefonkonferenz teilzunehmen, rufen Sie bitte 1-877-869-3847 (USA), 1-201-689-8261 (außerhalb der USA), Call-In-ID: KERYX. Die Wiederholung der Telefonkonferenz wird für die Wiedergabe an http://www.keryx.com , für einen Zeitraum von 15 Tagen nach der Telefonkonferenz.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmazeutika auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisencitrat Koordination Komplex), ein orales, Eisen auf Eisen basierenden Verbindung, die die Fähigkeit, sich an Phosphat binden und nicht resorbierbare Komplexe hat. Keryx hat ein US-basierten klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphat-Spiegel) bei Patienten mit chronischer Nierenerkrankung auf Dialyse abgeschlossen, durchgeführt im Rahmen eines Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration ( FDA). Die Gesellschaft New Drug Application (NDA) wird derzeit von der FDA mit einer zugeordneten Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) wird bis zur Vorlage. Das Unternehmen entwickelt auch Zerenex in den USA für die Verwaltung der erhöhten Phosphor und Eisenmangelanämie bei Patienten mit Stufen 3-5 nicht-Dialyse abhängig chronischen Nierenerkrankungen. Darüber hinaus hat Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd seiner New Drug Application für die Marktzulassung von Eisencitrat eingereicht in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung. Keryx ist in New York City ansässig.
Kontakt:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com
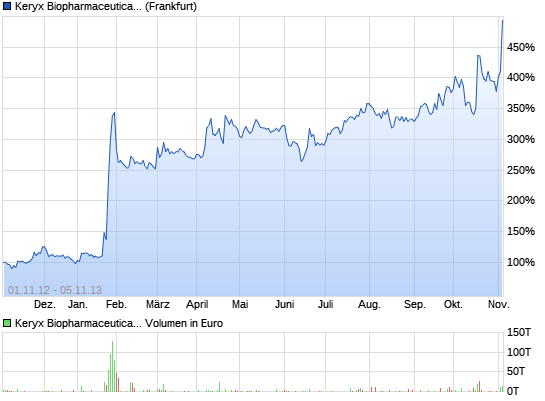
Datum Erster Hoch Tief Schluss Stücke Volumen
05.11.13 13,01 14,07 12,95 13,939 $ * 2.977.488 40,2 M
04.11.13 11,10 11,33 10,83 11,10 $ 2.851.745 31,6 M
01.11.13 10,50 10,94 10,40 10,64 $ 1.950.983 20,6 M
http://finance.yahoo.com/news/...zerenex-meets-primary-131154013.html
Keryx Biopharmazeutika angekündigt erfolgreichen Top-Line-Ergebnisse aus der Phase-2-Studie von Zerenex in Nicht-Dialyse abhängig chronischen Nierenerkrankung Patienten mit erhöhten Serum-Phosphor und Eisenmangelanämie. In dieser Studie erfüllt Zerenex beiden co-primären Endpunkte, wie unten beschrieben, zeigen hoch signifikante Veränderungen des Serum-Phosphor-und Transferrin-Sättigung im Vergleich zu Placebo über den 12-wöchigen Behandlung. Darüber hinaus trafen sich die wichtigsten Zerenex sekundären Endpunkte der zunehmenden Ferritin und Hämoglobin und abnehmender Fibroblasten-Wachstumsfaktor-23 im Vergleich zu Placebo. Das Unternehmen plant, mit der FDA zusammen, um diese Daten mit dem Ziel, die einen Weg nach vorn zur Erlangung eines markierten Indikation für die Behandlung von Eisenmangelanämie bei NDD-CKD-Patienten zu diskutieren.
Hopfen und Malz,Gott erhalt's !!!
MFG
Chali
Dumme Leute wurden auch viel mehr geben, ich bin schon die Meinung das es eine sehr schlaue Kampagne ist ;)