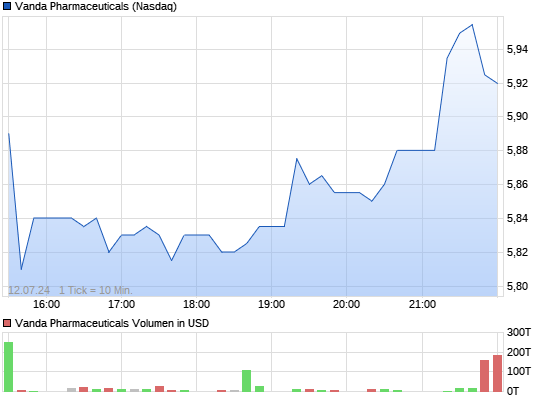
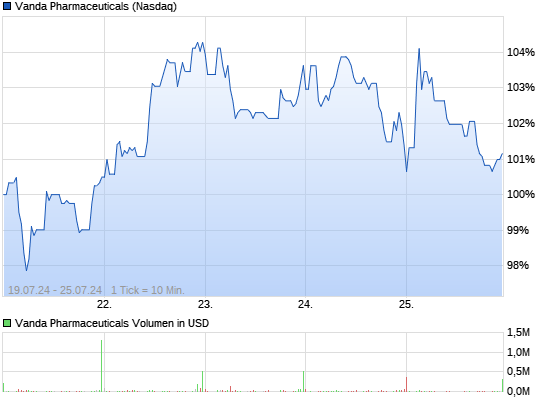
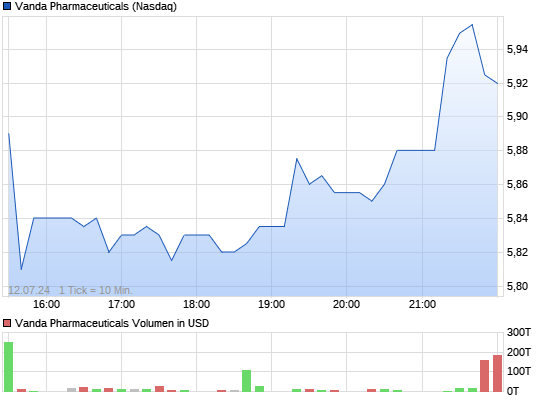
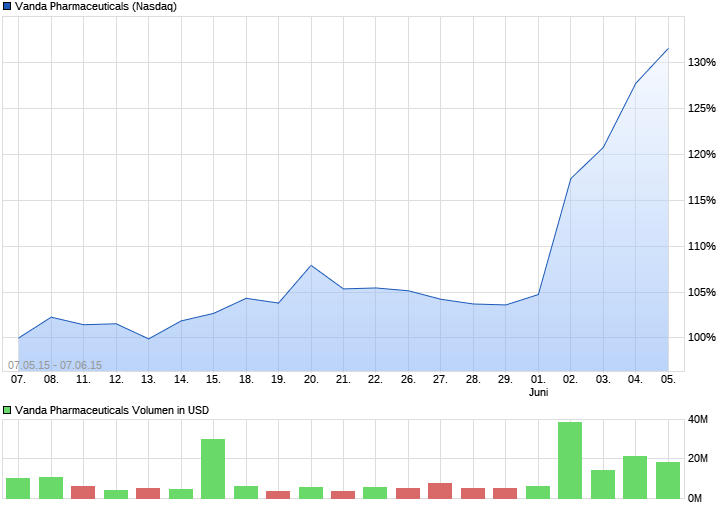
VANDA PHARMACEUTICALS rebound ?
http://finance.yahoo.com/news/...eview-supports-vandas-131344564.html
12. November (Reuters) - Eine experimentelle Schlafstörung Medikament von Vanda Pharmaceuticals Inc hergestellt ist sicher und wirksam genug, um Zustimmung rechtfertigen, fand ein US-Food and Drug Administration Bewertung.
Der Bericht, geschrieben auf der FDA-Website am Dienstag, kommt zwei Tage vor einem Treffen außerhalb medizinischen Experten, die das Medikament zu besprechen und empfehlen, ob sie genehmigt werden sollten wird. Die FDA ist nicht verpflichtet, den Rat von seiner beratenden Gremien folgen aber in der Regel tut.
Die Droge, tasimelteon, wurde entwickelt, um Non-24-Stunden-Disorder oder Non-24, eine Störung des Tagesrhythmus, die am häufigsten in der völlig blind ist gefunden und kann gestört nächtlichen Schlaf und übermäßige Tagesschläfrigkeit Ursache zu behandeln.
Datum Erster Hoch Tief Schluss Stücke Volumen
12.11.13 12,17 12,74 11,07 12,50 $ * 10.333.270 125 M
11.11.13 6,22 6,93 6,11 6,788 $ 2.430.625 14,8 M
08.11.13 5,85 6,36 5,70 6,24 $ 1.863.048 10,5 M
07.11.13 6,62 6,95 5,80 5,84 $ 2.868.758 17,4 M
06.11.13 6,68 6,73 6,13 6,45 $ 1.292.274 7,79 M
05.11.13 7,47 7,50 6,62 6,68 $ 1.283.326 7,06 M
04.11.13 7,03 7,80 6,925 7,50 $ 1.478.501 10,9 M
01.11.13 7,14 7,30 6,81 7,02 $ 1.091.151 7,61 M
13.10 14.11.13
PR Newswire
WASHINGTON, 14. November 2013
http://www.ariva.de/news/...y-Committee-to-Review-HETLIOZ-NDA-4845898
WASHINGTON, November 14, 2013 / PRNewswire / - Vanda Pharmaceuticals Inc. (VANDA) (NASDAQ: VNDA), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems konzentriert, gab heute bekannt, dass der Handel mit NASDAQ Vanda gemeinsamen gestoppt Lager an diesem Morgen.
Des peripheren und zentralen Nervensystem Drugs Advisory Committee der US-amerikanischen Food and Drug Administration (FDA) erfüllt heute Vanda New Drug Application (NDA) für tasimelteon, vorgesehener Handelsname HETLIOZ ™, überprüfen für die Behandlung von Nicht-24-Stunden-Disorder in die völlig blind. Der Beratende Ausschuss Sitzung ist für 08.00 Uhr ET geplant.
Vanda HETLIOZ ™ NDA wird derzeit Priority Review durch die FDA mit einer Aktion unter dem Zieldatum Prescription Drug User Fee Act (PDUFA-V) vom 31. Januar 2014.
Ansprechpartner für Investoren:
Chad Rubin
Vice President
Die Trout Group
(646) 378-2947
crubin@troutgroup.com
Kontakt für die Medien:
Laney Landsman
Assistant Vice President
Makowski
(212) 508-9643
llandsman@makovsky.com
SOURCE Vanda Pharmaceuticals Inc.
Quelle: PR Newswire
5.00 15.11.13
PR Newswire
http://www.ariva.de/news/...order-Non-24-in-the-Totally-Blind-4846923
WASHINGTON, 14. November 2013
WASHINGTON, November 14, 2013 / PRNewswire / - Vanda Pharmaceuticals Inc. (VANDA) (NASDAQ: VNDA) gab heute bekannt, dass die US Food and Drug Administration (FDA) peripheren und zentralen Nervensystem Drugs Advisory Committee (Beirat) mit überwältigender Mehrheit die Zustimmung empfehlen von Vanda New Drug Application (NDA) für tasimelteon, vorgeschlagenen Handelsnamen HETLIOZ ™, für die Behandlung von Nicht-24-Stunden-Disorder (Non-24) in der völlig blind.
Der Beirat festgestellt, dass:
Non-24 ist eine geeignete Indikation für eine FDA-zugelassene Therapie;
die klinischen Endpunkte sind geeignet, um die Anzeige zu unterstützen;
gibt es aber deutliche Hinweise auf Wirksamkeit in tasimelteon Non-24; und
und die Sicherheit der tasimelteon in Non-24 angemessen berücksichtigt wurde.
"Wir sind sehr erfreut, dass die FDA beratender Ausschuss hat empfohlen, dass die FDA genehmigt HETLIOZ ™ zur Behandlung von Non-24 in der völlig blind", sagte Mihael H. Polymeropoulos MD., Vanda President und Chief Executive Officer. "Wir sind jetzt einen Schritt näher in Richtung unseres Ziels der Bereitstellung eine Behandlungsoption, die die physiologische Ursache dieser schweren, schwächende Waise Bedingung, die eine Mehrheit der völlig blind Individuen auswirkt Adressen."
Vanda tasimelteon NDA wird derzeit Priority Review von der FDA für die Behandlung von Non-24 in der völlig blind, mit einer Aktion unter dem Zieldatum Prescription Drug User Fee Act (PDUFA-V) vom 31. Januar 2014.
Die FDA gewährt Priority Review Status für eine "Droge, die eine ernsthafte Erkrankung behandelt und, wenn zugelassen wird, wäre eine deutliche Verbesserung der Sicherheit oder Wirksamkeit liefern" über aktuelle Therapien. Derzeit gibt es keine zugelassene Behandlung für Non-24 und HETLIOZ ™ hat das Potenzial, diese ungedeckten medizinischen Bedarf.
Über Nicht-24-Stunden-Disorder
Non-24 ist eine schwere, seltene und chronische Störung des Tagesrhythmus durch die Unfähigkeit, mitzureißen (synchronisieren) der Master innere Uhr mit dem 24-Stunden-Tag-Nacht-Zyklus gekennzeichnet. Non-24 betrifft die Mehrheit der völlig blind Individuen oder zwischen 65.000 und 95.000 Menschen in den USA Nicht-24 tritt fast ausschließlich bei Personen, die die Lichtempfindlichkeit notwendig mitzureißen Master innere Uhr im Gehirn mit der 24-Stunden-Tag fehlt Nacht-Zyklus. Die meisten Menschen haben einen Master innere Uhr, die natürlich länger läuft als 24-Stunden-und Licht ist die wichtigste Umwelt-Cue, dass es setzt zu 24 Stunden pro Tag. Personen mit dem Non-24 haben eine innere Uhr, die Meister nicht zurückgesetzt wird, und ständig Verzögerungen, was längere Versatz zwischen ihren Tagesrhythmus und der 24-Stunden-Tag-Nacht-Zyklus, einschließlich des Zeitpunkts von Melatonin und Cortisol-Sekretion. Als Ergebnis dieser Versatz, Nicht-24 mit erheblichen Störungen des Schlaf-Wach-Zyklus und Beeinträchtigungen der sozialen und beruflichen Funktionsfähigkeit assoziiert und markiert subjektive Bedrängnis. Derzeit gibt es keine zugelassene Behandlung des Non-24. Für weitere Informationen über Nicht-24, besuchen Sie bitte www.non-24.com .
Über Tasimelteon
Tasimelteon schlug Handelsnamen HETLIOZ ™ ist eine zirkadiane Regler in der Entwicklung für die Behandlung von Non-24. Tasimelteon ist ein Dual-Melatonin-Rezeptor-Agonisten (DMRA) mit selektiver Agonist Aktivität an den MT1 und MT2-Rezeptoren. Tasimelteon zielt darauf ab, den Master innere Uhr im Nucleus suprachiasmaticus (SCN) zurückgesetzt, was in der Mitnahme der körpereigenen Melatonin und Cortisol Rhythmen auf die 24-Stunden-Tag-Nacht-Zyklus auszurichten. Das Patent behauptet Tasimelteon als eine neue chemische Einheit erstreckt sich bis Dezember 2022, unter der Annahme einer 5-Jahres-Verlängerung unter dem Hatch-Waxman Act gewährt werden. Tasimelteon wurde Orphan Drug Designation zur Behandlung von Non-24 aus den USA und der Europäischen Union gewährt. Tasimelteon wurde nicht von der FDA oder anderen Regulierungsbehörde genehmigt wurden.
Über Vanda Pharmaceuticals Inc.
Vanda Pharmaceuticals Inc. ist ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems fokussiert. Weitere Informationen über Vanda, besuchen Sie bitte http://www.vandapharma.com .
Kontakt zum Unternehmen:
Jim Kelly
Senior Vice President und Chief Financial Officer
Vanda Pharmaceuticals Inc.
(202) 734-3428
jim.kelly @ vandapharma.com
Ansprechpartner für Investoren:
Chad Rubin
Vice President
Die Trout Group
(646) 378-2947
crubin@troutgroup.com
Kontakt für die Medien:
Laney Landsman
Assistant Vice President
Makowski
(212) 508-9643
llandsman@makovsky.com
Vorbehalt bei Zukunftsaussagen AUSSAGEN
Verschiedene Aussagen in dieser Pressemitteilung sind "zukunftsgerichtete Aussagen" gemäß den Wertpapiergesetzen. Wörter wie, aber nicht beschränkt auf, "glauben", "erwarten", "antizipieren", "schätzen", "beabsichtigen", "planen", "projizieren", "Ziel", "Ziel", "wahrscheinlich", " wird "," würde "und" könnte ", oder die Verneinung dieser Begriffe und ähnliche Ausdrücke oder Wörter, kennzeichnen solche vorausschauenden Aussagen. Zukunftsgerichtete Aussagen beruhen auf den derzeitigen Erwartungen, die Risiken, Änderungen der Umstände, Annahmen und Ungewissheiten. Wichtige Faktoren, aufgrund derer die tatsächlichen Ergebnisse erheblich von jenen unterscheiden, in der Gesellschaft zukunftsgerichteten Aussagen abweichen, gehören unter anderem: die FDA nicht nach dem beratenden Ausschuss der Empfehlung, Vanda Versagen zu erhalten, oder eine Verzögerung bei der Beschaffung, Zulassung für tasimelteon für die Behandlung von Nicht-24-Stunden-Disorder oder mit laufenden regulatorischen Anforderungen und andere Faktoren, die im Abschnitt "Risk Factors" und "Management Discussion and Analysis of Financial Condition und Ertragslage" Abschnitte des Jahresberichts Vanda auf Formblatt 10 beschrieben sind, entsprechen -K für das Geschäftsjahr zum 31. Dezember 2012 und dem Quartalsbericht auf Formblatt 10-Q für das Quartal zum 30. September 2013, die bei den Akten der SEC und auf der Website der SEC unter sind www.sec.gov . Zusätzlich zu den oben genannten Risiken und Vanda Jahresbericht auf Formblatt 10-K und die Quartalsberichte auf Formular 10-Q, andere unbekannte oder unvorhersehbare Faktoren auch Vanda die Ergebnisse beeinflussen könnten, beschrieben. Es kann keine Zusicherung, dass die tatsächlichen Ergebnisse oder Entwicklungen von Vanda erwartet realisiert wird oder werden, auch wenn im Wesentlichen realisiert, dass sie die erwarteten Folgen zu haben, oder die Auswirkungen auf, Vanda sein. Es kann daher keine Zusicherung gegeben werden, dass die Ergebnisse in solchen zukunftsgerichteten Aussagen und Schätzungen angegeben erreicht wird.
Alle schriftlichen und mündlichen zukunftsgerichteten Aussagen zuzuschreiben Vanda oder jede Person, die in ihrem Namen werden ausdrücklich in ihrer Gesamtheit durch die warnenden Aussagen enthaltenen oder erwähnten qualifiziert. Vanda warnt Investoren nicht zu stark auf die zukunftsgerichteten Aussagen Vanda macht oder dass in ihrem Namen gemacht. Die Informationen in dieser Pressemitteilung wird nur ab dem Datum dieser Pressemitteilung zur Verfügung gestellt, und Vanda übernimmt keinerlei Verpflichtung, und lehnt ausdrücklich jede Verpflichtung zur Aktualisierung oder Überarbeitung öffentlich irgendwelche zukunftsgerichteten Aussagen, ob als Ergebnis von neuen Informationen, zukünftigen Ereignissen oder andernfalls.
SOURCE Vanda Pharmaceuticals Inc.
Quelle: PR Newswire
Geschrieben von CapitalCube am 4. Juni 2015 in Yahoo Finance | 1712 Aufrufe | Lassen Sie eine Antwort
http://www.capitalcube.com/blog/index.php/...-by-strong-fundamentals/
Vanda Pharmaceuticals, Inc. relative Bewertung unterschätzt und es hat eine grundlegende Analyse Punktzahl von 69.
Unsere Analyse basiert auf einem Vergleich Vanda Pharmaceuticals, Inc. mit folgenden Peers basierend - Paratek Pharmaceuticals Inc, Pfizer Inc ., Titan Pharmaceuticals, Inc., Eli Lilly and Company, Novartis AG Sponsored ADR , Bristol-Myers Squibb Company, Pernix Therapeutics Holdings, Inc., Merck & Co., Inc. und Johnson & Johnson (PRTK-US, PFE-US , TTNP-US, LLY-US, NVS-US , BMY-US, PTX-US, MRK-US und JNJ-US ).
Vanda Pharmaceuticals, Inc. hat hervorragende Leistung gezeigt Gesamt, sowohl über das letzte Jahr sowie im letzten Monat. In der Tat, Vanda Pharmaceuticals, Inc. Die Kursdynamik im letzten Monat, um 20.82% ist besser als im letzten Jahr, der 12,39% betrug. Auch von einer Peer-Gruppe Perspektive Vanda Pharmaceuticals, Inc. hat sich besser durchgeführt, da der Peer-Group-Leistung war 1,48% im letzten Monat.
Unternehmensprofil
Von einem Peer-Analyse Sicht ist relative Outperformance letzten Monat up von einem Median Performance im vergangenen Jahr.
Vanda Pharmaceuticals Inc. Trades zu einem niedrigeren Kurs / Buch mehrere (3.13) als sein Vergleichsgruppenmedian (4,22).
Wir klassifizieren VNDA-US als Harvesting aufgrund der trotz seines relativ hohen Renditen relativ niedrigen Wachstumserwartungen des Marktes.
VNDA-US hat eine relativ hohe Gewinnmargen beim Betrieb mit mittleren Vermögens Umdrehungen.
Gegenüber dem Jahreswechsel des Unternehmens bei Umsatz und Ergebnis besser als der Median unter seiner Vergleichsgruppe.
Im Laufe der letzten fünf Jahre, VNDA-US hat return 's auf Vermögenswerte von unten Median um besser als der Median unter seinesgleichen verbessert, was darauf hindeutet, dass das Unternehmen seine relative Operationen deutlich verbessert.
Relativ hohen Vorsteuermarge des Unternehmens schlägt eine strenge Kontrolle der Betriebskosten im Vergleich zu Altersgenossen.
Während VNDA-US Umsatzwachstum ist in den letzten Jahren über dem Vergleichsgruppenmedian gewesen ist, ist P / E-Verhältnis der Aktie geringer ist als der Vergleichsgruppenmedian darauf hindeutet, dass das Ergebnis der Gesellschaft sein kann, Höchststand, und der Markt erwartet einen Rückgang des Wachstumserwartungen.
Das Unternehmen die Investitionsprogramm und aktuellen Renditen deuten darauf hin, dass das Unternehmen wahrscheinlich machen große Wetten auf die Zukunft.
VNDA USA derzeit keinen Schulden.
Unsere Analyse Raten Vanda Pharmaceuticals, Inc., wie im Vergleich zur Konkurrenz unterbewertet.
Aktienkursentwicklung
Von einem Peer-Analyse Sicht ist relative Outperformance letzten Monat up von einem Median Performance im vergangenen Jahr.
Während VNDA-US 's Veränderung der Aktienkurs von 12,39% für die letzten 12 Monate ist im Einklang mit seiner Peer-Median, ist seine neueren 30-Tage-Kursentwicklung von 20,82% über dem Vergleichsgruppenmedian. Dies legt nahe, die Leistung des Unternehmens hat sich in jüngster Zeit in Bezug auf Kollegen verbessert.
Share Price Performance
Quadrant Label Erläuterung. Bewegen Sie mehr wissen
Führende, Fading, Verzögerung Rising
Relative Bewertung
Relative Valuation
Fundamental Score
Vanda Pharmaceuticals, Inc. den Preis von USD 11.43 niedriger als CapitalCube 's Preis von USD 13.57. CapitalCube der Ansicht, dass auf diesen Ebenen, Vanda Pharmaceuticals, Inc. unterbewertet ist und verfügt über Aufwärtspotenzial. Im Laufe der letzten 52 Wochen hat sich die Aktie zwischen USD 8,34 und USD 16.50 schwankte.
Valuation & Peer Metrics
Eine vollständige Liste der Bewertungskennzahlen ist auf dem Firma-Seite zur Verfügung.
Klicken Sie hier um zu sehen
Firmenprofil
Vanda Pharmaceuticals Inc. ist ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems. Das Produktportfolio umfasst Fanapt und Tasimelteon. Die Fanapt Produkt eine Verbindung für die Behandlung von Schizophrenie, der oralen Formulierung von, die derzeit vermarktet wird und in den USA von Novartis erhältlich. Die Tasimelteon Produkt eine Verbindung für die Behandlung von Schlafstörungen und Stimmungsstörungen, einschließlich zirkadianer Rhythmus Schlafstörungen, die derzeit in der klinischen Entwicklung. Vanda Pharmaceuticals wurde von Mihael Hristos Polymeropoulos und Argeris N. Karabelas 2002 gegründet und hat seinen Hauptsitz in Washington, DC.
http://www.ariva.de/news/...pt-Patents-in-the-FDA-Orange-Book-5444115
13.05 03.08.15
PR Newswire
WASHINGTON, 3. August 2015
WASHINGTON, August 3, 2015 / PRNewswire / - Vanda Pharmaceuticals Inc. (Vanda) (NASDAQ: VNDA) gab heute bekannt, dass vier neue Fanapt ® Patente sind nun in der US Food and Drug Administration Veröffentlichung freigegeben Drug Products Mit therapeutische Äquivalenz Evaluierungen enthalten sind, allgemein bekannt als das Orange Book. Patent Nummer 9.072.742 läuft im Januar 2031. Patent Nummer 9.074.254 läuft im Dezember 2031. Patent Nummer 9.074.255 läuft im Dezember 2030. Patent Nummer 9.074.256 läuft im Februar 2031.
Vor diesen neu gelistet Patente waren die Fanapt ® Orange Book aufgeführten Patente der US Zusammensetzung, Patent, das '610-Patent, das' 776-Patent und dem '638-Patent, voraussichtlich im November 2016, November 2027 auslaufen, August 2030 und Oktober 2030 auf.
Über Vanda Pharmaceuticals Inc.
Vanda Pharmaceuticals Inc. ist ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems. Weitere Informationen über die Vanda, besuchen Sie bitte www.vandapharma.com .
Vorbehalt bei Zukunftsgerichtete Aussagen
Verschiedene Aussagen in dieser Mitteilung sind "zukunftsgerichtete Aussagen" im Rahmen der Wertpapiergesetze. Zukunftsgerichtete Aussagen basieren auf aktuellen Erwartungen, die Risiken, Änderungen der Umstände, Annahmen und Unsicherheiten beinhalten basiert. Wichtige Faktoren, die dazu führen, dass die tatsächlichen Ergebnisse wesentlich von den in Vanda Die zukunftsgerichteten Aussagen abweichen können, sind unter anderem Annahmen Vanda betreffend das Leben der Fanapt ® Patente und andere Faktoren, die im Abschnitt "Risikofaktoren" beschrieben sind, und "Erläuterungen und Analyse der Vermögens- und Ertragslage "Abschnitten des Jahresberichts Vanda auf Formular 10-K für das Geschäftsjahr zum 31. Dezember 2014 und Quartalsbericht auf Formular 10-Q für das Quartal zum 30. Juni 2015, die auf Datei sind bei der SEC und auf der Website der SEC erhältlich unter www.sec.gov . Zusätzlich zu den oben und im Jahresbericht Vanda auf Formular 10-K und Quartalsberichte beschrieben auf Formular 10-Q Risiken, andere unbekannte oder unvorhersehbare Faktoren könnten auch Vanda der Ergebnisse beeinflussen. Es kann nicht garantiert werden, dass die tatsächlichen Ergebnisse oder Entwicklungen von Vanda erwartet realisiert oder, wenn auch im Wesentlichen realisiert, dass sie die erwarteten Folgen oder Auswirkungen auf, Vanda haben. Es kann daher keine Zusicherung gegeben werden, dass die in solchen vorausschauenden Aussagen und Schätzungen angegeben Ergebnisse erreicht wird.
Unternehmenskontakt:
Jim Kelly
Senior Vice President und Chief Financial Officer
Vanda Pharmaceuticals Inc.
(202) 734-3428
jim.kelly@vandapharma.com
Kontakt für die Medien:
Laney Landsman
Vizepräsident
Makovsky
(212) 508-9643
llandsman@makovsky.com
Um die ursprüngliche Version auf PR Newswire zu sehen, visit: http://www.prnewswire.com/news-releases/...orange-book-300122170.html
SOURCE Vanda Pharmaceuticals Inc.
Quelle: PR Newswire
Quelle
http://www.ariva.de/news/...atment-of-Schizophrenia-in-Adults-5488988
13.05 15.09.15
PR Newswire
WASHINGTON, 15. September 2015
WASHINGTON, Sept. 15, 2015 / PRNewswire / - Vanda Pharmaceuticals, Inc. (Vanda) (NASDAQ: VNDA) gab heute bekannt, dass die US Food and Drug Administration (FDA) hat für die Überprüfung Vanda Einreichung einer ergänzenden New Drug Application (sNDA) für Fanapt akzeptiert ® , die Genehmigung als Instandhaltungs Behandlung von Schizophrenie bei Erwachsenen.
Vanda ist eine Zulassung auf Basis der Ergebnisse der Aufschub klinische Studie, die die langfristige Erhaltung der Wirksamkeit und Sicherheit von Fanapt ® ausgewertet.
Die FDA hat eine Nutzungsgebühr Ziel Datum unter dem Prescription Drug User Fee Act von 27. Mai 2016, dem Zieldatum für die FDA ihre Überprüfung der ergänzende Zulassungsantrag vollständig ist eingestellt.
Über Vanda Pharmaceuticals Inc.
Vanda Pharmaceuticals Inc. ist ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung von Produkten für die Behandlung von Erkrankungen des zentralen Nervensystems. Für mehr auf Vanda, besuchen Sie bitte www.vandapharma.com.
Über Fanapt ®
Fanapt ® ist ein atypisches antipsychotisches Mittel für die Behandlung von Schizophrenie bei Erwachsenen. Bei der Wahl zwischen den Behandlungen sollte der verordnende Arzt betrachten die Fähigkeit Fanapt ® das QT-Intervall und die Verwendung anderer Medikamente ersten verlängern. Der verschreibende Arzt sollte auch die Notwendigkeit, Fanapt® langsam titriert, um orthostatische Hypotonie, die zu verzögerten Wirksamkeit führen kann im Vergleich zu einigen anderen Arzneimitteln, die nicht ähnlich Titration benötigen zu vermeiden.
WICHTIGE WARNHINWEISE UND VORSICHTSMASSNAHMEN: erhöhte Mortalität bei älteren Patienten mit Demenz-assoziierter Psychose; QT-Verlängerung; malignes neuroleptisches Syndrom; Spätdyskinesien; Hyperglykämie und Diabetes mellitus; Gewichtszunahme; Krampfanfälle; orthostatische Hypotonie und Synkope; Leukopenie, Neutropenie und Agranulozytose; Hyperprolaktinämie; Regulierung der Körpertemperatur; Schluckbeschwerden; Selbstmord; Priapismus; Potenzial für die kognitiven und motorischen Beeinträchtigung.
Häufigsten beobachteten Nebenwirkungen von Fanapt ® (> = 5% und 2x Placebo): Schwindel, Mundtrockenheit, Müdigkeit, verstopfte Nase, orthostatische Hypotonie, Schläfrigkeit, Tachykardie, und das Gewicht erhöht.
Für die vollständigen US-Verschreibungsinformationen, einschließlich gerahmte Warnhinweise und Wichtige Informationen zur Sicherheit finden Sie auf unserer Website unter www.fanapt.com.
Vorbehalt bei Zukunftsgerichtete Aussagen
Verschiedene Aussagen in dieser Pressemitteilung, einschließlich, ohne Einschränkung, Aussagen in Bezug auf die Zielerfüllung von der FDA die Überprüfung der sNDA, sind "zukunftsgerichtete Aussagen" im Rahmen der Wertpapiergesetze. Zukunftsgerichtete Aussagen basieren auf aktuellen Erwartungen, die Risiken, Änderungen der Umstände, Annahmen und Unsicherheiten, einschließlich, ohne Einschränkung basiert, riskiert, dass die FDA die Überprüfung des sNDA nicht vollständig durch die Benutzungsgebühr Ziel Datum oder, dass die FDA nicht letztendlich genehmigt den sNDA. Wichtige Faktoren, die dazu führen, dass die tatsächlichen Ergebnisse wesentlich von den in Vanda Die vorausblickenden Aussagen abweichen könnten, sind in den "Risk Factors" "Erläuterungen und Analyse der Vermögens- und Ertragslage" Abschnitten des Jahresberichts Vanda auf Formular 10 gesetzt und -K für das Geschäftsjahr zum 31. Dezember 2014 und im Quartalsbericht auf Formular 10-Q für das Quartal zum 30. Juni 2015, die bei den Akten der SEC und verfügbar auf der Website der SEC an sind www.sec.gov. Zusätzlich zu den oben und im Jahresbericht Vanda auf Formular 10-K und Quartalsberichte beschrieben auf Formular 10-Q Risiken, andere unbekannte oder unvorhersehbare Faktoren könnten auch Vanda Ergebnisse beeinflussen. Es kann nicht garantiert werden, dass die tatsächlichen Ergebnisse oder Entwicklungen von Vanda erwartet realisiert oder, wenn auch im Wesentlichen realisiert, dass sie die erwarteten Folgen oder Auswirkungen auf, Vanda haben. Es kann daher keine Zusicherung gegeben werden, dass die in solchen zukunftsbezogenen Aussagen und Schätzungen angegebenen Ergebnissen erreicht wird.
Alle schriftlichen und mündlichen zukunftsgerichteten zuzurechnen Vanda oder jede andere Person in seinem Auftrag handelnde Aussagen werden ausdrücklich in ihrer Gesamtheit durch die warnenden Aussagen enthalten sind oder auf die hierin qualifiziert. Vanda warnt Investoren nicht zu stark von den vorausschauenden Aussagen Vanda macht oder die sich in ihrem Namen gemacht verlassen. Die Informationen in dieser Pressemitteilung wird nur ab dem Datum dieser Pressemitteilung zur Verfügung gestellt und Vanda verpflichtet sich nicht, und lehnt jegliche Verpflichtung, weder aufgrund neuer Informationen, zukünftiger Ereignisse oder aktualisieren oder zu revidieren öffentlich irgendwelche zukunftsgerichteten Aussagen, die speziell Andernfalls.
Unternehmenskontakt:
Jim Kelly
Senior Vice President und Chief Financial Officer
Vanda Pharmaceuticals Inc.
(202) 734-3428
jim.kelly@vandapharma.com
Kontakt für die Medien:
Laney Landsman
Vizepräsident
Makovsky
(212) 508-9643
llandsman@makovsky.com
Um die ursprüngliche Version auf PR Newswire zu sehen, visit: http://www.prnewswire.com/news-releases/...a-in-adults-300142878.html
SOURCE Vanda Pharmaceuticals Inc.
Quelle: PR Newswire
13.00 11.01.16
PR Newswire
WASHINGTON, 11. Januar 2016
http://www.ariva.de/news/...sults-and-2016-Financial-Guidance-5609613
WASHINGTON, Januar 11, 2016 / PRNewswire / - Vanda Pharmaceuticals, Inc. (Vanda) (NASDAQ: VNDA), ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung innovativer Therapien Bewältigung hoher medizinischer Bedarf besteht, gab heute vorläufige ungeprüfte Finanzergebnisse für das vierte Quartal und Gesamtjahr 2015 und seine Finanzprognose für das Jahr 2016.
Vorläufige Ergebnisse für das vierte Quartal 2015
Vanda geht davon aus, im vierten Quartal von HETLIOZ berichten 2015 Gesamtnettoproduktumsätze ® und Fanapt ® von ca. 31,8 Mio. $.
HETLIOZ ® Produktumsätze werden voraussichtlich rund 15,1 Mio. $.
Fanapt ® Produktumsätze werden voraussichtlich rund 16,7 Mio. $.
Vorläufiges Gesamtjahr 2015 Ergebnisse
Vanda rechnet bis 2015 Gesamtnettoproduktumsatz von HETLIOZ berichten ® und Fanapt ® von ca. 109.900.000 $, im Einklang mit Vanda vor Leitung von zwischen $ 100 und $ 115 Millionen.
HETLIOZ ® Nettoproduktumsatz für das Jahr 2015 werden voraussichtlich rund 44,3 Mio. $, im Einklang mit Vanda vor Leitung von zwischen $ 40 und $ 45 Millionen.
Fanapt ® Nettoproduktumsatz für das Jahr 2015 werden voraussichtlich rund 65,6 Mio. $, im Einklang mit Vanda vor Leitung von zwischen $ 60 und $ 70 Millionen.
Vanda endete 2015 mit rund 143 Millionen $ in bar, Zahlungsmitteläquivalente und marktgängige Wertpapiere ("Cash"), was einer Steigerung um Bargeld von rund 13 Mio. US $ im Jahr 2015.
2016 Finanzprognose
Vanda geht davon aus, dass folgende Finanzziele 2016 zu erreichen:
Net Produktverkäufe von beiden HETLIOZ ® und Fanapt ® von zwischen $ 143 und $ 153 Millionen.
HETLIOZ ® Produktumsätze von zwischen $ 73 und $ 78 Millionen.
Fanapt ® Produktumsätze von zwischen $ 70 und $ 75 Millionen.
Non-GAAP-Betriebsaufwendungen, ohne Kosten der verkauften Waren, von zwischen $ 125 und $ 135 Millionen. Die primären Treiber der zu erwartenden Zunahme gegenüber dem Vorjahr sind Investitionen in die US Fanapt ® und europäischen HETLIOZ ® Gewerbebetriebe.
Non-GAAP-Betriebsaufwand schließt auch immaterieller Vermögenswert Abschreibungsaufwand von 10,9 Mio. $ und aktienbasierte Vergütungen von zwischen $ 9 und $ 11 Millionen.
Barzahlung wird voraussichtlich um weniger als 20 Millionen $ in 2016 zu verringern.
Non-GAAP-Finanzinformationen
Vanda glaubt, dass die Non-GAAP-Finanzinformationen in dieser Pressemitteilung können Anleger in besseren Verständnis und die Beurteilung der laufenden Wirtschaftlichkeit Vanda Geschäfts- und reflektieren, wie es die Geschäfte intern und setzt operative Ziele. Vanda glaubt, dass ohne die Auswirkungen dieser Posten besser widerspiegelt die wiederkehrenden wirtschaftlichen Merkmale des Geschäfts, sowie die Verwendung der Finanzmittel Vanda und seine langfristige Performance.
Diese Pressemitteilung enthält einen Vorsprung 2016 Non-GAAP-Betriebsaufwendungen, ohne Kosten der verkauften Waren, einer zukunftsweisenden Nicht-GAAP-Finanzkennzahl unter der Überschrift "2016 Finanzprognose". Diese Non-GAAP financial measure wird durch den Ausschluss von Kosten der verkauften Waren, aktienbasierte Vergütungen und Abschreibungen immaterieller Vermögenswert ermittelt. Vanda ist nicht in der Lage, diese Nicht-GAAP-Anleitung zu GAAP in Einklang zu bringen, weil es schwierig ist, den zukünftigen Auswirkungen dieser Anpassungen vorauszusagen.
Diese Non-GAAP financial measure, wie vorgestellt, unter Umständen nicht vergleichbar mit ähnlich bezeichneten Kennzahlen anderer Unternehmen ist, da nicht alle Unternehmen können diese Maßnahmen in einer identischen Weise zu berechnen und werden daher sind sie nicht unbedingt ein genaues Maß für Vergleich zwischen Unternehmen.
Die Darstellung dieser Non-GAAP financial measure soll nicht isoliert oder als Ersatz für die Beratung in Übereinstimmung mit GAAP betrachtet werden. Die wichtigste Einschränkung dieser Non-GAAP financial measure ist, dass sie wichtige Elemente, die von GAAP erforderlich sind, um in Abschluss Vanda aufgezeichnet und ist damit ausgeschlossen. Darüber hinaus ist es unterliegen inhärent vorhandenen Grenzen, da sie die Ausübung der Beurteilungen des Managements bei der Bestimmung dieser Non-GAAP financial measure widerspiegelt.
Über Vanda Pharmaceuticals Inc.
Vanda Pharmaceuticals Inc. ist ein biopharmazeutisches Unternehmen auf die Entwicklung und Vermarktung innovativer Therapien Adressierung hohen ungedeckten medizinischen Bedarf konzentriert. Für mehr auf Vanda, besuchen Sie bitte www.vandapharma.com.
Vorbehalt bei Zukunftsgerichtete Aussagen
Verschiedene Aussagen in dieser Pressemitteilung, einschließlich, aber nicht beschränkt auf, Aussagen in Bezug auf die vorläufigen Ergebnisse für das vierte Quartal 2015 und das Gesamtjahr 2015 und der Finanzprognose 2016 in der Überschrift zu dieser Pressemitteilung und unter "2016 Finanzprognose" oben bereitgestellt , sind "zukunftsgerichtete Aussagen" im Rahmen der Wertpapiergesetze. Zukunftsgerichtete Aussagen basieren auf aktuellen Erwartungen, die Risiken, Änderungen der Umstände, Annahmen und Unsicherheiten beinhalten basiert. Wichtige Faktoren, die dazu führen, dass die tatsächlichen Ergebnisse wesentlich von den in Vanda Die vorausblickenden Aussagen abweichen könnten, umfassen unter anderem die Tatsache, dass die vorläufigen Finanzergebnisse Vanda sind ungeprüft und Veränderungen in der solche Ergebnisse können von Vanda Prüfer nach ihrer Prüfung der Ergebnisse erforderlich , Annahmen Vanda ist in Bezug auf seine Fähigkeit, auch weiterhin das Geschäft in den USA, Vanda Fähigkeit, erfolgreich zu vermarkten HETLIOZ ® in Europa und anderen Faktoren, die in den "Risikofaktoren" beschrieben sind, zu wachsen und "Erläuterungen und Analyse der Vermögens- und Ertragslage "Abschnitten des Jahresberichts Vanda auf Formular 10-K für das Geschäftsjahr zum 31. Dezember 2014 und im Quartalsbericht auf Formular 10-Q für das Quartal zum 30. September 2015, die bei den Akten der SEC und verfügbar auf der Website der SEC sind bei www.sec.gov. Zusätzliche Faktoren können in diesen Abschnitten des Jahresberichts Vanda auf Formular 10-K für das Geschäftsjahr zum 31. Dezember 2015, die bei der SEC im ersten Quartal 2016 eingereicht werden, zusätzlich zu den oben und in Vanda beschriebenen Risiken beschrieben werden Jahresbericht auf Formblatt 10-K und Quartalsberichte auf Formular 10-Q, andere unbekannte oder unvorhersehbare Faktoren könnten auch Vanda Ergebnisse beeinflussen. Es kann nicht garantiert werden, dass die tatsächlichen Ergebnisse oder Entwicklungen von Vanda erwartet realisiert oder, wenn auch im Wesentlichen realisiert, dass sie die erwarteten Folgen oder Auswirkungen auf, Vanda haben. Es kann daher keine Zusicherung gegeben werden, dass die in solchen zukunftsbezogenen Aussagen und Schätzungen angegebenen Ergebnissen erreicht wird.
Alle schriftlichen und mündlichen zukunftsgerichteten zuzurechnen Vanda oder jede andere Person in seinem Auftrag handelnde Aussagen werden ausdrücklich in ihrer Gesamtheit durch die warnenden Aussagen enthalten sind oder auf die hierin qualifiziert. Vanda warnt Investoren nicht zu stark von den vorausschauenden Aussagen Vanda macht oder die sich in ihrem Namen gemacht verlassen. Die Informationen in dieser Pressemitteilung wird nur ab dem Datum dieser Pressemitteilung zur Verfügung gestellt und Vanda verpflichtet sich nicht, und lehnt jegliche Verpflichtung, weder aufgrund neuer Informationen, zukünftiger Ereignisse oder aktualisieren oder zu revidieren öffentlich irgendwelche zukunftsgerichteten Aussagen, die speziell Andernfalls.
Unternehmenskontakt:
Jim Kelly
Senior Vice President und Chief Financial Officer
Vanda Pharmaceuticals Inc.
(202) 734-3428
jim.kelly@vandapharma.com
Kontakt für die Medien:
Laney Landsman
Assistant Vice President
Makovsky
(212) 508-9642
llandsman@makovsky.com
Um die ursprüngliche Version auf PR Newswire zu sehen, visit: http://www.prnewswire.com/news-releases/...al-guidance-300202026.html
SOURCE Vanda Pharmaceuticals Inc.
Vanda verklagt FDA
https://seekingalpha.com/news/...dipitant-shares-12-percent-premarket
Vanda meldet Zahlen für 2018
- Umsatz 193 Mio. $ (vgl. 165 Mio. $)
- HETLIOZ 116 Mio. $
- Fanapt 77 Mio. $
- HETLIOZ 116 Mio. $
- 2019 Umsatz Ausblick ~215-225 Mio. $
- Gewinn 25 Mio. $ (vgl. 16 Mio. $ Verlust)
http://phx.corporate-ir.net/...&p=irol-newsArticle&ID=2387356
Vanda meldet Zahlen für Q1/19
- Umsatz 48 Mio. $ (HETLIOZ® ~29 / Fanapt® ~19)
- Verlust 1 Mio. $
- Cash 268 Mio. $
- MK 727 Mio. $
https://vandapharmaceuticalsinc.gcs-web.com/...quarter-2019-financial
http://www.vandapharmaceuticals.com/
https://vandapharmaceuticalsinc.gcs-web.com/...4d25-ba5a-17e4edb363c5
http://www.vandapharma.com/pipeline.html
HETLIOZ®
Jet LagDisorder sNDA PDUFA target action date 8/16/2019
http://www.vandapharma.com/dev-hetlioz.html
As of April 24, 2019, there were 52,963,676 shares of the registrant’s common stock issued and outstanding.
MK
https://www.ariva.de/news/...ls-fda-update-for-hetlioz-in-the-7718342
Glaube nicht das es eine große Sache wird. Das wird.
https://www.ariva.de/news/...-to-announce-second-quarter-2019-7719682
Vanda meldet Zahlen für Q2/19
- Umsatz 59 Mio. $ (HETLIOZ® ~38 / Fanapt® ~21)
- Gewinn 12 Mio. $
- Cash 280 Mio. $
- MK 846 Mio. $
https://vandapharmaceuticalsinc.gcs-web.com/...quarter-2019-financial