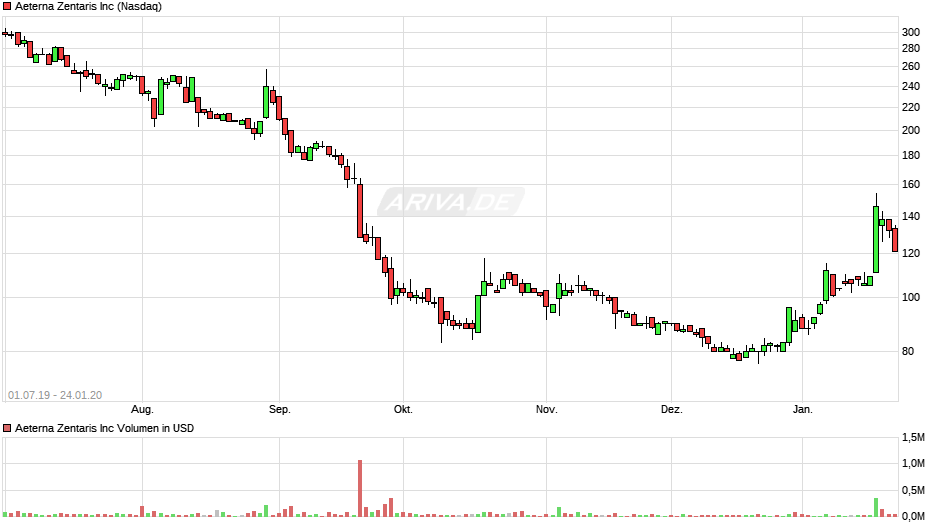
Aeterna nach dem Split
Report Ran On 24JAN2020 AND TIME 4:34
PRICE AS OF YESTERDAY: $1.33
TOTAL INSTITUTES TAKEN FOR THE STUDY:4,764
TIME FRAME:Q1-2018 To Q3-2019 [7 QUARTERS]
https://thinksabio-sample-files.s3.amazonaws.com/...ICAL_ANALYSIS.htm
Moderation
Zeitpunkt: 29.01.20 11:31
Aktion: Löschung des Beitrages
Kommentar: Regelverstoß - Aussagen bitte belegen
Zeitpunkt: 29.01.20 11:31
Aktion: Löschung des Beitrages
Kommentar: Regelverstoß - Aussagen bitte belegen
GlobeNewswireJanuary 27, 2020
Quelle
https://finance.yahoo.com/news/...ns-compliance-nasdaq-133510364.html
Am 23. Januar 2020 erhielt Aeterna ein Schreiben von Nasdaq mit der Begründung, dass die Aktie von Aeterna den Bid Price wieder einhält, da die Aktien des Unternehmens an mindestens zehn (10) aufeinanderfolgenden Geschäftstagen einen Schlusskurs von 1,00 USD je Aktie oder mehr hatten Regel. Nasdaq hält die Angelegenheit für erledigt.
Moderation
Zeitpunkt: 29.02.20 18:29
Aktion: Löschung des Beitrages
Kommentar: Regelverstoß - Unbelegte Aussage
Zeitpunkt: 29.02.20 18:29
Aktion: Löschung des Beitrages
Kommentar: Regelverstoß - Unbelegte Aussage
Immerhin haben Sie sich den Nasdaq Status gesichert, und wer es bis jetzt noch nicht gerafft hat, wie der Hase läuft,
Sorry
Selbst Schuld
Gier frißt Hirn
Über meine Jahrelange Warnungen, und Empfehlungen zu diesen Thema wird sich ja nur lustig gemacht.
Nur ICH fahr hier "keine" Verluste, sammle nur ERFAHRUNGEN !!!
.. die beim gefakten AE-Verkaufsprogrammhypchen hoffnungsfroh zugegriffen haben sitzen bereits nett in den Miesen - ganz normal für AE-Investierte.
Der Kurs geht zügig nach unten - wie weit wissen nur die AE-Börsenverbrecher. Auf jeden Fall werden sie alles tun, um Kleinanleger auf keinen Fall zu bevorteilen ..
The same procedure as everytime!
Nur die Longis, welche vor dem Split zu 0,48-0,65 rein sind, und im Laufe der Jahre durch Zukäufe verbilligt haben, sind die D....
Aber wär hält denn schon Bio Techs von Phase I- Zulassung durchgängig?
Daten Q2 2020
https://www.zentaris.com/press-releases
GlobeNewswire 28. Januar 2020
https://finance.yahoo.com/news/...s-completion-patient-130010828.html
G-Übersetzung
- Studie P01 ist die erste von zwei Studien, die mit der EMA im pädiatrischen Untersuchungsplan des Unternehmens für Macimorelin als Wachstumshormonmangel-Diagnostikum vereinbart wurde. -
- Ergebnisse der Studie P01 werden für das zweite Quartal 2020 erwartet -
CHARLESTON, SC, 28. Januar 2020 (GLOBE NEWSWIRE) - Aeterna Zentaris Inc. ( AEZS ) („Aeterna“ oder das „Unternehmen“), ein auf die Vermarktung neuartiger pharmazeutischer Therapien spezialisiertes biopharmazeutisches Unternehmen, gab heute bekannt Erfolgreicher Abschluss der Patientenrekrutierung für die erste pädiatrische Studie mit Macimorelin als Wachstumshormonstimulationstest zur Beurteilung des Wachstumshormonmangels („GHD“) bei Kindern. Diese Studie, AEZS-130-P01 („Studie P01“), ist die erste von zwei Studien, die mit der Europäischen Arzneimittelagentur („EMA“) im PIP-Plan (Pediatric Investigation Plan) des Unternehmens für Macimorelin vereinbart wurden. Macimorelin, ein Ghrelinagonist, ist ein oral aktives kleines Molekül, das die Sekretion von Wachstumshormon aus der Hypophyse in den Kreislauf stimuliert.
Das Ziel der Studie P01 ist es, eine Dosis zu ermitteln, die sowohl sicher an pädiatrische Patienten verabreicht werden kann als auch einen deutlichen Anstieg der Wachstumshormonkonzentration bei Personen verursacht, bei denen letztendlich diagnostiziert wurde, dass sie keine GHD haben. Die aus Studie P01 abgeleitete empfohlene Dosis wird in der zentralen zweiten Studie AEZS-130-P02 zur diagnostischen Wirksamkeit und Sicherheit bewertet. Die Studie P01 ist eine internationale multizentrische Studie, die in Ungarn, Polen, der Ukraine, Serbien und Russland durchgeführt wird.
Dr. Nicola Ammer , Chief Medical Officer von Aeterna, kommentierte: „Wir freuen uns, die Patientenrekrutierung in dieser wichtigen Studie für die pädiatrische Entwicklung von Macimorelin abgeschlossen zu haben. In allen Dosierungskohorten der Studie P01 wurde die Verabreichung von Macimorelin Ende Dezember 2019 sicher abgeschlossen. “
Bei der Studie P01 handelt es sich um eine offene Studie zum Gruppenvergleich, zur Dosissteigerung, zur Untersuchung der Sicherheit, Verträglichkeit und Pharmakokinetik / Pharmakodynamik („PK / PD“) von Macimorelinacetat nach ansteigenden oralen Einzeldosen von Macimorelin in Mengen von 0,25, 0,5 und 1,0 mg pro kg Körpergewicht bei pädiatrischen Patienten von 2 bis unter 18 Jahren mit Verdacht auf GHD. Das Unternehmen nahm in den drei Kohorten der Studie insgesamt 24 pädiatrische Patienten auf.
„Der Abschluss der Patientenrekrutierung in Studie P01 ist ein wichtiger Meilenstein und ein wichtiger Schritt in der pädiatrischen Entwicklung von Macimorelin bei dieser wichtigen Patientenpopulation. Wir freuen uns auf den erfolgreichen Abschluss der Studie P01 und werden voraussichtlich im zweiten Quartal 2020 endgültige Ergebnisse vorlegen “, sagte Dr. Klaus Paulini , Vorstandsvorsitzender von Aeterna.
Nach Studienprotokoll absolvieren alle eingeschlossenen Patienten nach erfolgreichem Abschluss des Screeningzeitraums vier Studienbesuche. Bei Besuch 1 und Besuch 3 wird ein provokativer GH-Stimulationstest gemäß den örtlichen Praktiken der Studienorte durchgeführt. Bei Besuch 2 wird der Macimorelin-Test durchgeführt: Nach der oralen Verabreichung der Macimorelin-Lösung werden zu vordefinierten Zeiten Blutproben für die PK / PD-Beurteilung entnommen. Besuch 4 ist eine Sicherheitsuntersuchung am Studienende.
Weitere Informationen zu Studie P01 finden Sie im EU-Register für klinische Studien unter der Referenz EudraCT # 2018-001988-23.
Über Macimorelin
Macimorelin, ein Ghrelinagonist, ist ein oral aktives kleines Molekül, das die Sekretion von Wachstumshormon aus der Hypophyse stimuliert. Stimulierte Wachstumshormonspiegel werden in Blutproben nach oraler Verabreichung von Macimorelin zur Beurteilung der GHD gemessen.
Im Dezember 2017 erteilte die US-amerikanische Zulassungsbehörde FDA (Food and Drug Administration) Aeterna Zentaris die Marktzulassung für Macimorelin zur Diagnose von Patienten mit Wachstumshormonmangel bei Erwachsenen (AGHD). Macrilen ™ wurde von der FDA die Orphan Drug-Zulassung für die Diagnose von AGHD erteilt. Im Januar 2019 erteilte die Europäische Kommission Aeterna Zentaris die Genehmigung für das Inverkehrbringen von Macimorelin zur Diagnose eines Wachstumshormonmangels bei Erwachsenen. Im März 2017 stimmte der Pädiatrieausschuss der EMA dem PIP des Unternehmens für Macimorelin zu, eine Voraussetzung für die Einreichung eines Zulassungsantrags für jedes neue Arzneimittel in Europa.
Die Studie P01 ist eine internationale multizentrische Studie, die in Ungarn, Polen, der Ukraine, Serbien und Russland durchgeführt wird.
Eine "Ostblock" Studie.
Wie Zoptrex, da waren es die Asiaten.
01/15/2020 350980 164224 2.137203
12/31/2019 372768 122536 3.04211
verbraten.
Hab oft genug gebredigt, wie es hier abläuft, aber wer nicht hören will, muß fühlen.
Moderation
Zeitpunkt: 04.02.20 20:10
Aktion: Löschung des Beitrages
Kommentar: Regelverstoß - Bleiben Sie bitte sachlich.
Zeitpunkt: 04.02.20 20:10
Aktion: Löschung des Beitrages
Kommentar: Regelverstoß - Bleiben Sie bitte sachlich.
Wäre schade, wenn "Kleinwüchsigkeit" nicht behandelt werden kann.
Aber KLEINE Menschen muß es auch geben, denn wer soll dann den ganzen Schrott in den Super-Märkten kaufen. (Bückdich Ware)
Nicht jedes gute Produkt hat die Chance, ganz oben gelistet, und eingereit zu werden.
Schaft es daher Mac?
kölle alaaf 4:0
Geiles Spiel wieder einmal - die Mannschaft ist heiß - so können sie oben bleiben!! ;-))
Gratulation!!
Außer sie starten einen fundamentlosen (wie alles hier) Gaunerfakehype. Dann versuche ich den mitzuspielen. Jedenfalls sollte man nicht zu lange in sein ..
Die Gauner könnten jeden Tag einen Kleinanlegertotalverlust starten!!